
14.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是 。
(2)实验步骤②明显不合理,理由是 。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是 。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
 请根据表中数据作出硫酸亚铁的溶解度曲线。
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,
应控制的结晶温度(t)的范围为 。
13.以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用
。
(3)Ⅲ中,生成FeCO3的离子方程式是
。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是 
。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2  2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量 Kg。(摩尔质量/g·mol-1:FeCO3 116
Fe2O3 160 FeO 72)
Kg。(摩尔质量/g·mol-1:FeCO3 116
Fe2O3 160 FeO 72)
12.下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
11.下列有关物质检验的实验结论正确的是
|
选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
10.钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
A.反应①、②中电子转移数目相等 B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
9.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高 B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中慢
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
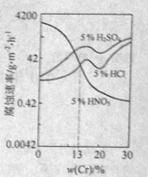
8.右图是三种稀酸对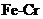 合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
A.稀硝酸对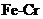 合金的腐蚀性比稀硫酸和稀盐酸的弱
合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)
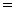 Fe(NO3)3+3NO2 ↑+3H2O
Fe(NO3)3+3NO2 ↑+3H2O
C. Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所
以对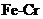 合金的腐蚀性最强
合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对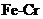 合金的腐蚀性减弱
合金的腐蚀性减弱
7.能正确表示下列反应的离子方程式是
A.将铜屑加入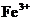 溶液中:
溶液中: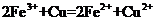
B.将磁性氧化铁溶于盐酸: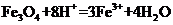
C.将氯化亚铁溶液和稀硝酸混合: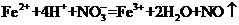
 D.将铁粉加入稀硫酸中:
D.将铁粉加入稀硫酸中: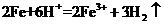
6.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中不一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
5.将5.4g Al 投入到200.0mL 2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com