

1、平衡常数是反应进行程度的标志
一般认为K >105反应较完全,K<105反应很难进行。平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如:
N2(g) + O2(g) 2NO(g) K = 1×10 - 30(298K)
2NO(g) K = 1×10 - 30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
另外还有两点必须指出:
(1)平衡常数数值的大小,只能大致告诉我们一个 可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
2SO2(g) + O2===2SO3(g) 298K时k很大,但由于速度太慢,常温时,几乎不发生反应。
(2)平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:N2 + O2 2NO
2NO
K = 10-30(298K)所以常温下用此反应固定氮气是不可能的。
3、由于水的物质的量浓度为一常数(55.6 mol·L-1),因平衡常数已归并,书写时不必写出。
2、由于固体浓度为一常数,所以在平衡常数表达式中不再写出。
1、化学平衡常数K表示可逆反应进行的程度。
(1)化学平衡常数K只针对达到平衡状态的可逆反应适用,非平衡状态不适用。
(2)化学平衡常数K的表达式与可逆反应的方程式书写形式有关。对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K正=1/K逆。
(3)K值越大,表示反应进行的程度越大,反应物转化率或产率也越大。
(4)K值不随浓度或压强的改变而改变,但随着温度的改变而改变。
(5)一般情况下, 对于正反应是吸热反应的可逆反应,升高温度,K值增大;而对于正反应为放热反应的可逆反应,升高温度,K值减少。
对于正反应是吸热反应的可逆反应,升高温度,K值增大;而对于正反应为放热反应的可逆反应,升高温度,K值减少。
在一定温度下,可逆反应无论从正反应开始还是从逆反应开始,无论反应混合物的起始浓度是多少,当反应达到平衡状态时,正反应速率等于逆反应速率,反应混合物中各组成成分的含量保持不变,即各物质的浓度保持不变。生成物浓度的幂次方乘积与反应物浓度的幂次方乘积之比是常数,这个常数叫化学平衡常数,用K表示。
化学平衡常数的计算公式为:
对于可逆反应:mA(g) + nB(g) pC(g) + qD(g)
pC(g) + qD(g)
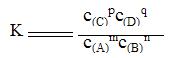
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com