

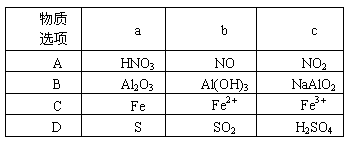
13.下表所列各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
12.能在水溶液中大量共存的粒子组是
A.H+、NH4+、CO32-、NO3- B.K+、Al3+、SO42-、NH3
C.Na+、K+、SO32-、Cl2 D.H+、Fe3+、Cl-、NO3-
11.元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
10.下表中分子(或离子)、分子(或离子)对应的立体结构以及对立体结构的解释均正确的是
|
|
分 子 |
立体结构 |
原 因 |
|
A |
甲醛(HCHO) |
平面三角形 |
C原子采用sp2杂化且C原 子的价电子均参与成键 |
|
B |
三氯甲烷(CH3Cl) |
正四面体 |
C原子采用sp3杂化且C原子 的价电子均参与成键 |
|
C |
铵根离子(NH4+) |
三角锥型 |
N原子采用sp3杂化且4个 N-H完全一样 |
|
D |
水合氢离子(H3O+) |
三角锥型 |
O原子采用sp3杂化但O原 子有一对价电子未参与成键 |
9.下列对一些物质性质的递变性以及原因的说法错误的是
A.碱金属元素从Li到Rb金属性逐渐增强,因为从Li到Rb原子半径逐渐增大
B.卤化氢的热稳定性从HF到HI逐渐减弱,因为从HF到HI分子间作用力逐渐减小
C.氧族元素气态氢化物从H2O到H2Te沸点逐渐升高,因为从H2O到H2Te相对分子质量逐渐增大
D.碱土金属氧化物从MgO到BaO熔点逐渐降低,因为从从MgO到BaO晶格能逐渐减小
8.NH3极易溶于水的原因是
① NH3之间能形成氢键;② NH3与H2O之间能形成氢键;③ NH3和H2O均为极性分子;④ H2O之间能形成氢键;⑤ NH3能与H2O反应生成NH3·H2O。
A.①②③ B.①④⑤ C.②③④ D.②③⑤
不定项选择题:本题包括6小题,每小题4分,共24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。
7.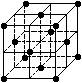 设阿伏伽德罗常数的值为NA,下列结论错误的是
设阿伏伽德罗常数的值为NA,下列结论错误的是
A.完全电解2 mol H2O断裂的σ键键数为4NA
B.标准状况下,11.2 L CO2中含有的π键键数为2 NA
C.60 g SiO2晶体中含有的Si-O键键数为4NA
D.128 g 金属铜中含有如图所示的晶胞数为0.5 NA
6.下列各组物质熔点或沸点由高到底的顺序正确的是
A.熔点:AlCl3>MgCl2>NaCl B.沸点:水蒸气>水>冰
C.熔点:金刚石>碳化硅>晶体硅 D.沸点:HBr>HCl>HF
5.下列离子中不存在配位键的是
A.O22- B.NH4+ C.FeSCN2+ D.AlF63-
4.下列叙述正确的是
A.H2、Cl2、HCl分子中的共价键完全一样
B.乙炔分子中的有2个极性σ键、1个非极性σ键、2个非极性π键
C.N≡N的键能>N-N键能的三倍,所以N2分子中π键比σ键稳定
D.由极性键形成的分子一定是极性分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com