
2、设AB是长为1的一条线段,等分AB得到分点A1,再等分线段A1B得到分点A2,如此无限继续下去,线段AA1,A1A2,…,An-1An,…的长度构成数列
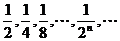 ①
①
可以看到,随着分点的增多,点An越来越接近点B,由此可以猜想,当n无穷大时,AA1+A1A2+…+ An-1An 的极限是________.下面来验证猜想的正确性,并加以推广
1、等比数列的前n项和公式是_________________________________________________
21.(8分)向100 mL BaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如下图所示:
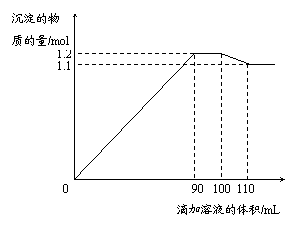
请回答下列问题:
⑴ 加入的溶液B的体积从90 mL至100 mL之间时发生的离子反应方程式是 ▲ ;溶液B中Na2SO4与NaOH的物质的量浓度之比为 ▲ 。
⑵ 当加入B溶液110 mL时,得到的沉淀的化学式是 ▲ 。沉淀的质量为 ▲ 。
⑶ 若忽略原混合溶液A中的H+、OH-,则A中各离子浓度之间的关系为 ▲ [用一个含c(Cl-)、c(Al3+)、 c(Ba2+)、c(Fe3+)的等式表示]。其中c(Fe3+)= ▲ ,c(Cl-)= ▲ 。
如东县2008-2009学年第二学期期末调研考试
20.
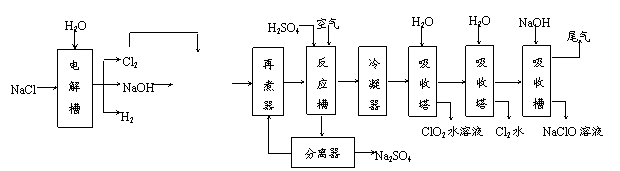 (12分)二氧化氯(ClO2),黄绿色气体,易溶于水但不易与水反应,是一种高效强氧化剂,世界卫生组成(WHO)将它列为水体安全消毒的首选物质。目前较为先进的生产方法如下:
(12分)二氧化氯(ClO2),黄绿色气体,易溶于水但不易与水反应,是一种高效强氧化剂,世界卫生组成(WHO)将它列为水体安全消毒的首选物质。目前较为先进的生产方法如下:
请回答下列问题:
⑴ 初始原料NaCl可从海水中提取。从海水中得到的粗盐中含有Mg2+、Ca2+、SO42-等杂质离子。将粗盐溶于水后,依次加入稍过量的 ▲ 等三种物质(写化学式),经过滤等操作,可得精制盐。
⑵ Cl2与NaOH溶液在高温下反应的产物之一是NaClO3,写出高温反应槽中反应的离子方程式 ▲ 。
⑶ 反应槽中通入的空气不参与反应。写出反应槽中发生的化学反应方程式为 ▲ ,该反应中氧化产物与还原产物的物质的量之比为 ▲ 。通入空气的作用是 ▲ 。
⑷ 上述生产流程中,有一个循环过程,循环使用的物质是 ▲ 。最后的吸收槽中加入NaOH溶液的作用是 ▲ 。
⑸ 该方法生产得到的ClO2中可能含有的杂质是 ▲ 。
19.(12分)有E、Q、T、X、Z、M六种前四周期元素,原子序数E<Q<T<X<Z<M。E的基态原子有三个能级,每个能级中填充的电子数相等,Q的基态原子与E的基态原子具有相同的能层和能级,且Q的基态原子核外有2个未成对电子。T、X、Z三种元素处于同一周期,X与E同主族,Z与Q同主族,T与Q能形成TQ型化合物。M的原子序数为24。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
⑴ 写出与EQ互为等电子体的单质的结构式 ▲ 、基态M原子的核外电子排布式 ▲ 。
 ⑵ T、X、Z三种原子第一电离能由大到小的顺序为 ▲ 。T与Z形成的化合物的电子式为 ▲ 。
⑵ T、X、Z三种原子第一电离能由大到小的顺序为 ▲ 。T与Z形成的化合物的电子式为 ▲ 。
⑶ Q与X形成的化合物晶体类型为 ▲ ,该化合物中Q、X之间的共价键为 ▲ 键。
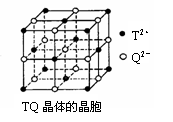
⑷ TQ晶体的晶胞如右图所示。每个TQ晶胞中试剂含有的T2+个数为 ▲ ,TQ晶体的熔点高于NaCl,原因是 ▲ 。
⑸ T单质晶体中T原子的堆积模式为 ▲ 。
a.非密置层的非密堆积 b.非密置层的密堆积
c.密置层的非密堆积 d.密置层的最密堆积
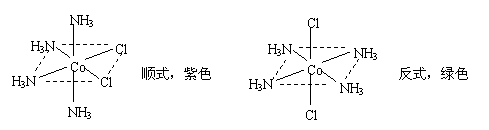
18.(10分)在CoCl2溶液中加入NH3和NH4Cl的混合溶液,用氧化剂把Co2+氧化为Co3+后加入盐酸,在不同反应条件下可得不同颜色的配合物,其中组成相同的绿、紫两种配合物的化学式为[Co(NH3)4Cl2]Cl,[Co(NH3)4Cl2]+的结构分别如下:
请回答下列问题:
⑴ [Co(NH3)4Cl2]+中中心离子的配位数为 ▲ 。基态Co3+的核外电子排布式为 ▲ 。
⑵ [Co(NH3)4Cl2]+的一个单位正电荷中心位于Co3+上的是 ▲ (填序号)。
a.顺式 b.反式 c.顺式和反式 d.顺式和反式均不在
⑶ NH3分子之间能形成氢键,但HCl分子之间不能形成氢键,原因是 ▲ 。
⑷ NH3中中心原子的轨道杂化方式是 ▲ ,NH3的立体结构为 ▲ 。
⑸ Cl和N的电负性均为3.0,但却能发生如下反应:2NH3+3Cl2=N2+6HCl,可能的原因是 ▲ (填序号)。
a.Cl原子结合H的能力更强 b.E(H-Cl)>E(H-N)
c.N2比Cl2更稳定 d.Cl2的非金属性>N2
17.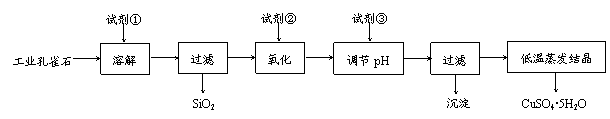 (10分)胆矾(CuSO4·5H2O)可用作纺织品印染的媒染剂、农业和渔业的杀虫剂、杀菌剂、饲料添加剂及镀铜和选矿药剂等。以工业孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]为原料制备胆矾的步骤如下(试剂①适当过量,试剂②、试剂③均适量):
(10分)胆矾(CuSO4·5H2O)可用作纺织品印染的媒染剂、农业和渔业的杀虫剂、杀菌剂、饲料添加剂及镀铜和选矿药剂等。以工业孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]为原料制备胆矾的步骤如下(试剂①适当过量,试剂②、试剂③均适量):
已知相关氢氧化物开始沉淀和沉淀完全时的pH如下,请回答下列问题:
|
氢氧化物 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Mn(OH)2 |
|
开始沉淀的pH |
4.2 |
7.6 |
2.7 |
8.3 |
|
完全沉淀的pH |
6.7 |
9.6 |
3.7 |
9.8 |
⑴ 若实验室进行溶解、过滤、蒸发结晶等操作时,均要用到的玻璃仪器是 ▲ 。
⑵ 试剂①的化学式为 ▲ 。工业孔雀石用试剂①溶解后过滤,得到的滤液中含有的金属离子有Cu2+、Fe2+、Fe3+。滤液氧化的目的是 ▲ ,氧化时发生的离子反应方程式为 ▲ (试剂②在下列物质中选择:KMnO4、Cl2、H2O2、NaClO)。
⑶ 调节pH时应将pH调节至 ▲ 。试剂③可选用 ▲ (填序号)。
a.NaOH b.Cu c.Fe d.CuO e.Fe2O3 f.Cu(OH)2
⑷ 检验Fe3+是否沉淀完全的实验操作是 ▲ 。
⑸ 若氧化时加入的试剂②过量,则在调节pH时,选用Cu也可以达到目的,原因是 ▲ 。
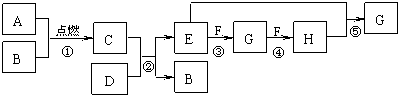
16.(10分)下图是中学化学中常见的一些单质或化合物之间的转化关系图,其中部分反应中涉及到的水未列出。已知A、B、F均为无色气体,A、C、F均参与动植物的生命活动;D是金属单质,E与盐酸反应的产物之一是厨房中最常见的调味品。
请回答下列问题:
⑴ 组成A的元素在元素周期表中的位置为 ▲ 。
⑵ 写出:
① 反应②的离子方程式为 ▲ ;
② 反应④的化学方程式为 ▲ 。
⑶ 请列举出2种方法区别G和H:
① 方法一 ▲ ;
② 方法二 ▲ 。
15.(10分)某澄清溶液,可能含有的离子如下:
阳离子:H+、Na+、K+、Ag+、NH4+、Mg2+、Ba2+、Fe2+、Al3+、Fe3+;
阴离子:I-、Cl-、OH-、NO3-、MnO4-、HCO3-、CO32-、SO32-、SO42-。
请回答下列问题:
⑴ 若要证明该溶液中存在大量H+,应进行的实验操作是 ▲ 。
⑵ 若要证明该溶液中存在大量I-,应进行的实验操作是 ▲ 。
⑶ 若要证明该溶液中存在大量Ba2+,应进行的实验操作是 ▲ 。
⑷ 当该溶液同时大量存在H+、I-、Ba2+时,还可能大量存在的离子有 ▲ 。
⑸ 用离子方程式表示,当该溶液同时大量存在H+、I-、Ba2+时,Fe3+不能大量存在的原因
▲ 。
14.有HNO3、H2SO4的混合溶液100mL,其中:c(NO3-)=0.4mol/L,c(SO42-)=0.1mol/L。向该溶液中加入1.92 g Cu粉,加热充分反应。若忽略溶液体积变化,则所得溶液中c(Cu2+)为
A.0.15mol/L B.0.225mol/L C.0.25mol/L D.0.30mol/L
非 选 择 题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com