
3、“撇开道德方面的考虑,秦朝只维持了那么短的时间,也是一件好事。不寻常的是尽管昙花一现,它却成功地把一套国家官僚机器的制度传给了它的政治继任者。”这套“制度”包括( )
① 行省制度 ② 皇帝制度 ③郡县制度 ④三公九卿制度
A.①②③ B.②③④ C.①② D.①②③④
2、西周一贵族的妻室和子嗣状况见下表,其中处于大宗地位的应是 ( )
|
妻室 |
子嗣 |
|
妻(正配) |
B.二哥(20岁)D.四哥(15岁) |
|
妾一(侧室) |
A.大哥(23岁) |
|
妾二(侧室) |
C.三哥(18岁) |
1、台海网2007年12月25日讯,蒋家媳妇蒋方智怡计划将两蒋(蒋介石和蒋经国)移灵浙江奉化安葬,在台湾引起了轩然大波。中国有句古话:叶落归根,认祖归宗。她的这种文化情节源于中国古代的( )
A.宗法制 B.分封制 C.禅让制 D.王位世袭制
31.在一个固定容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度下,发生如下反应在:2H2(g) +CO(g) 
 CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L。则:
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L。则:
(1)以H2的浓度变化表示的该反应的速率为 。
(2)达平衡时CO的转化率 。
(3)起始时容器内压强为P1,达平衡后容器压强为P2,P1= P2。
瑞安中学2008学年第二学期高二年级期中考试
30.(6分)反应aA(g) +bB(g) 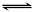 cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则:
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则:
(1)平衡时A与B的转化率之比是_______________。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d) (填“>”“=”“<”或“没关系”)。
(3)设定a=2 ,b=1,c=3,d=2,在甲、乙、丙、丁4个容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 。
17.对于可逆反应:A(g)+B(g)  2C(g)
△H<0,下列各图正确的是
2C(g)
△H<0,下列各图正确的是
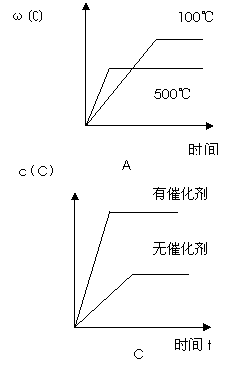 |
||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||
 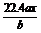 B. B.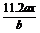 C.
C.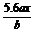 D.
D.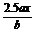 19.在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是:
19.在铁制品上镀上一定厚度的锌层,以下电镀方案中正确的是:A.锌作阳极,铁制品作阴极,溶液中含Fe2+ B.锌作阴极,铁制品作阳极,溶液中含Zn2+ C.锌作阴极,铁制品作阳极,溶液中含Fe3+ D.锌作阳极,铁制品作阴极,溶液中含Zn2+ 20.在相同温度下,已知2H2(g)+O2(g)=2H2O(g) △H1 ;2H2(g)+O2(g)=2H2O(l) △H2;H2(g)+1/2O2(g)=H2O(l) △H3,则△H1,△H2,△H3大小关系为: A.△H1=△H2=△H3 B.2△H3=△H2>△H1 C.△H3>△H2>△H1 D.2|△H3|=|△H2|>|△H1| 21.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是: A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1 B.在两个阳极上得到的产物的物质的量不相等 C.硝酸亚汞的化学式为HgNO3 D.硝酸亚汞的化学式为Hg2(NO3)2 22.按如下图甲装置进行实验,若乙中坐标图x轴表示流入电极的电子的物质的量,则下列叙述不正确的是:  A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量 C.F表示反应生成氧气的物质的量 D.F表示生成硫酸的物质的量 23.在水中加入等物质的量的Ag+、、Pb2+、Na+、、SO42-、、NO3-、、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量之比为: A. 35.5 :108 B. 16 :207 C. 8 :1 D. 108 :35.5 24.化合物HIn在水溶液中因存在以下电离平衡,故可作酸碱指示剂  HIn(aq) H+(aq)+In-(aq) HIn(aq) H+(aq)+In-(aq)(红色) (黄色) 现把下列物质溶于水配制成0.02mol/L的水溶液,其中能使指示剂显黄色的是: ①HCl ②SO2 ③NaHSO4 ④氨气 ⑤Na2O2 ⑥NaOH A.①②③ B.①③ C.④⑤⑥ D.④⑥ 25.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应: 2R(气)+5Q(气)= 4X(气)+nY(气) 反应完全后,容器温度不变,混合气体的 压强是原来的87.5%,则化学方程式中的n值是 A.2 B.3 C.4 D.5 第II卷(非选择题,共50分) 二、填空题:(每空2分,共28分) 26.(4分)同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。 已知:P4(s,白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1 ① P(s,红磷)+O2(气体)=P4O10(固体) △H=-738.5kJ·mol-1 ② (1)由热化学方程式来看,更稳定的磷的同素异形体是_______________________________。 (2)试写出白磷转化为红磷的热化学方程式___________________________________。 27.(10分)铝和氢氧化钾都是重要的工业产品。请回答: (1)工业冶炼铝的化学方程式是___________________________________。 (2)铝与氢氧化钾溶液反应的离子方程式是_______________________________。 (3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。 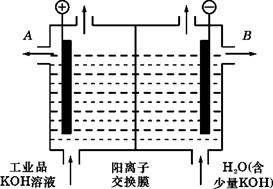 ①该电解槽的阳极反应式是
。 ①该电解槽的阳极反应式是
。②已知水是极弱的电解质,存在电离平衡: H2O  H++OH-。通电开始后,阴极附近溶液的 H++OH-。通电开始后,阴极附近溶液的pH会增大,请简述原因 。 ③除去杂质后的氢氧化钾溶液从溶液出口 (填“A”或“B”)导出。 28.(14分)在500℃、2×107Pa和催化剂条件下, 把物质A,B按物质的量之比2∶1充入固定容积 为2L的密闭容器中,发生如下反应: 2A(g)+ B(g)  2C(g)
△H=-180kJ·mol-1 2C(g)
△H=-180kJ·mol-1(1)写出该反应的化学平衡常数表达式K=_________________________ 。 (2)降低温度,该反应K值______,化学反应速度_____(以上均填“增大,减小或不变”)。 (3)在此条件下向此容器中充入2molA和过量的B,充分反应后,放出的热量______180kJ(填“<”“>”“=”),理由_________________________________________________________。 (4)关于该反应的下列说法中,正确的是__________。 A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S>0 D.△H<0,△S<0 (5)在上述反应条件的密闭容器中,欲提高A和B的转化率,下列措施可靠的是___(填字母)。 A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体 C.改变反应的催化剂 D.分离出物质C 三、实验题 (每空2分,共16分) 29.(10分)某化学研究小组为探究某化学问题, 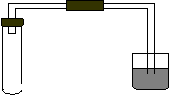 设计了如下的探究实验:在A 、B 、C 、D 、E 设计了如下的探究实验:在A 、B 、C 、D 、E等5支试管中分别放入干燥的细铁丝、浸过食盐水 的细铁丝、浸过清水的细铁丝、装配成右图所示 的5套装置,每隔一段时间测量导管中水面上升 的高度,结果如下表所示。(表中所列数据为导管水面上升的高度,单位:cm)
(1)实验前如何检验该装置的气密性?____________________________________________。 (2)写出B瓶中正极反应的电极方程式____________________________________和电池反应的化学方程式________________________________________________。 (3)通过实验得到的数据,可以得出结论:钢铁的吸氧腐蚀是铁和_______________共同作用的结果,若是电解质溶液导电性越强,则腐蚀越______(填“容易”、“难”或“无影响”)。 16.下列情况下,反应速率相同的是: A.等体积、等浓度的盐酸和硫酸分别与等质量的碳酸氢钠粉末反应 B.等质量的锌粒分别与等体积、等浓度的盐酸和硝酸反应 C.等体积、等浓度的盐酸和硝酸分别与等质量的碳酸钠粉末反应 D.等体积的0.2mol/L盐酸和0.1mol/L硫酸分别与分别与同种石灰石反应 15.关于如图所示装置的叙述,正确的是: A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少 C.电流从锌片经导线流向铜片 D.铜离子在铜片表面被还原 14. 下列该蓄电池推断错误的是: ① 放电时,Fe参与负极反应,NiO2参与正极反应 ② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-= Fe + 2OH- ③ 放电时,电解质溶液中的阴离子向正极方向移动 ④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
A.只有③ B.③④ C.④⑤ D.①②⑤ 13. A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ B.若X、Y不均为气态,则平衡气体平均摩尔质量:Ⅰ>Ⅱ C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同 D.平衡时Ⅰ容器的体积小于V L 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |