
2、The writer of the novel is a professor in his .
A、thirtieth B、thirty C、thirty’s D、thirties
1、It is reported that the United States uses energy as the whole of Europe.
A、as twice B、twice much C、twice much as D、twice as much
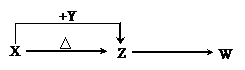 例3 (2005年北京理综)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
例3 (2005年北京理综)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
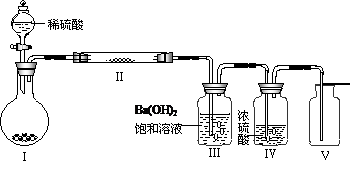
①装置Ⅰ中反应的化学方程式是 。
装置Ⅱ中物质的化学式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
解析:本题为无机框图+化学实验的新题型。根据题目信息,X、Y、Z的焰色均为黄色,说明这三种物质的阳离子均含Na+,题目关于X的信息较充分, X含除钠元素外的三种元素,X在加热条件转化为Z,Z可以制取无色无味的气体W,推知X为NaHCO3,Z为Na2CO3,W为CO2。向NaHCO3中加入NaOH,也可得到Na2CO3,所以Y为NaOH。
问题⑶中X含有的四种元素分别为Na、H、C、O,实验装置中的未知物质均由这四种元素中的几种组成。在实验装置图中,I中的物质能与稀硫酸反应产生气体,所以I中固体物质可以是NaHCO3或Na2CO3,产生的气体为CO2。产生的CO2与II中的固体反应,生成不与碱反应、可用浓硫酸干燥且密度比空气大的无色气体,而符合条件且由Na、H、C、O四种元素中的几种组成的物质仅有Na2O2,V中收集到的气体为O2。由四种元素中的两种组成的在催化剂存在下可制备O2的物质为H2O2,
问题⑷为新化学方程式的书写。根据信息,向Na2CO3中通入Cl2可以产生NaHCO3和NaClO,其中氯元素的化合价由0升高到+1价,因此氯元素也应同时0降低到-1价,生成NaCl。
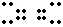 答案:⑴O
C O ⑵HCO3―+OH―=H2O+CO2↑⑶Na2CO3+H2SO4=Na2SO4+CO2↑+H2O, 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O, Na2O2 ⑷2Na2CO3+Cl2+H2O=2NaHCO3+NaClO↑+NaCl
答案:⑴O
C O ⑵HCO3―+OH―=H2O+CO2↑⑶Na2CO3+H2SO4=Na2SO4+CO2↑+H2O, 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O, Na2O2 ⑷2Na2CO3+Cl2+H2O=2NaHCO3+NaClO↑+NaCl
点评:形式是内容的载体,元素化合物知识与基本理论、化学实验等知识结合的全新形式为无机框图推断题目注入了新的活力。学习中应注意对各部分知识的梳理,寻找知识之间的联系,科学应对学科内的综合题目。
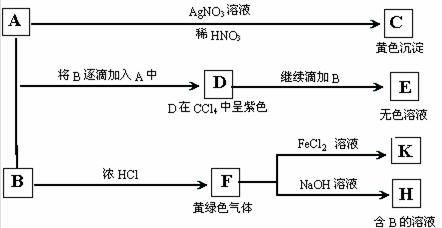 例2(2005年天津理综)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
例2(2005年天津理综)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
请回答:
⑴ 出A、B和C的化学式:A_______________,B______________,C____________。
⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
____________________________________________;
____________________________________________。
⑶ 写出将SO2气体通入K溶液发生反应的离子方程式:
___________________________________________。
⑷ 写出由F→H的化学方程式:
____________________________________________。
解析:本题主要考察了卤素单质化合物间转化关系,信息较多,物质推断较易,但有几个新反应需推理判断较复杂,在推断时应打乱条件出现的先后顺序,由易到难进行分析。黄色沉淀C为AgI,则A为NaI。黄绿色气体F为Cl2,Cl2与NOH溶液反应生成NaCl 、NaClO,呈碱性并具有氧化性的为NaClO,因此B为NaClO。Cl2可把FeCl2氧化为FeCl3,则K为FeCl3。D在 CCl4溶液显紫色,故D为I2,A+B→D中I元素化合价升高,则Cl元素化合价降低,NaClO转化为NaCl。D+B→E则为I2 + ClO-→IO3-+ Cl-。要注意的是,A+B→D、D+B→E两个过程中溶液均显碱性,利用电子得失守恒配平反应时方程式中不能出现H+。SO2+FeCl3反应,S元素化合价升高到+6价,SO2转化为SO42-(或H2SO4),Fe元素化合价降低+2价,FeCl3转化为FeCl2,此反应溶液显酸性,反应中不能出现OH-。
答案:⑴ NaI NaClO AgI ⑵ 2I- + ClO- + H2O == I2 + Cl- + 2OH-
I2 + 5ClO- + 2OH- == 2IO3-+ 5Cl- + H2O
⑶ 2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42- + 4H+
⑷ Cl2 + 2NaOH == NaCl + NaClO + H2O
点评:无机框图题中涉及课本没有的新反应,可能是无机框图求变的一个方向。例1中的NH3+ NaClO→N2H4,例3中的第⑷小题也是考察陌生的新反应。新反应一般为氧化还原反应,要先根据元素化合价的变化情况和题目条件确定反应物和生成物,然后根据电子得失守恒配平方程式。
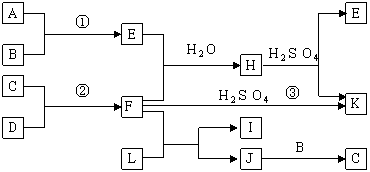 例1 (2006年江苏化学卷)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
例1 (2006年江苏化学卷)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
解析:本题综合考察了Cl、S、N等非金属元素的单质和化合物的相互转化。形成酸雨的污染物E为SO2,B常温常压下为气体,故A为S,B为O2。Cl2与NaOH溶液反应生成的具有漂白性的L是NaClO。H与H2SO4反应生成SO2和K,而K又是氮肥,所以H应是(NH4)2SO3或NH4HSO3,K为(NH4)2SO4,F为NH3。F为NH3,则C、D就为N2、H2,其中J被O2氧化生成C,而H2不能被氧化得到,故C为N2,D为H2,J中含有N元素。由NaClO(L)+NH3(F)→I+J知,J中元素应为Na、Cl、O、H的一种,又J的相对分子质量为32,故J中另一元素为H,设J化学式为NXHY(X、Y为整数),则14X+Y=32,仅当X=2,Y=4成立。因此J为N2H4── 一种我们没有学过陌生物质。
答案:⑴2NH3+H2SO4= (NH4)2SO4 ⑵N≡N (NH4)2SO3或NH4HSO3 ⑶ClO-+SO2+2OH-=Cl-+SO42-+H2O ⑷N2H4
点评:对于新物质的推断,首先应根据反应确定所含元素,然后确定各元素原子的个数之比,从而确定新物质的化学式。
6.(★★★★★)
汽车质量为5 t,其发动机额定功率为37.5 kW,汽车在水平道路上从静止开始起动,开始一段时间内,以加速度1.0 m/s2做匀加速运动,最后匀速运动的速度为15 m/s.求:
(1)汽车做匀加速运动的时间.
(2)汽车匀速运动后关闭发动机,还能滑多远?
5.(★★★★★)质量为m=4×103 kg的汽车发动机的额定功率P0=40×103 W,汽车从静止开始,以a=0.5 m/s2的加速度做匀加速直线运动,所受阻力恒为Ff=2×103 N,求:
(1)汽车匀加速运动所用的时间t;
(2)汽车可达的最大速度vm;
(3)汽车速度为2vm/3时的加速度a′
4.(★★★★)额定功率为80 kW的汽车,在平直的公路上行驶的最大速度为20 m/s.已知汽车的质量为2×103 kg,若汽车从静止开始做匀加速直线运动,加速度的大小为2 m/s2.假定汽车在整个运动过程中阻力不变.求:
(1)汽车受到的阻力Ff;
(2)汽车在3 s末的瞬时功率;
3.(★★★★)(2002年上海春考)铁路提速,要解决许多技术问题.通常,列车阻力与速度平方成正比,即f=kv2.列车要跑得快,必须用大功率机车来牵引.试计算列车分别以 120 km/h和40 km/h的速度匀速行驶时,机车功率大小的比值.(提示:物理中重要公式有F=ma,W=Fs′,P=Fv,s=v0t+ at2)
at2)
2.(★★★★)质量为5.00×105 kg的机车,以恒定的加速度从静止出发,经5 min行驶2.25 km,速度达到最大值54 km/h,则机车的功率为_____W.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com