
11.下列说法正确的是 ( )
A.要氧化除去FeCl2溶液中含有I-杂质,可加入的试剂是FeCl3
B.已知:常温时,下列三个反应都能自发的向右进行:2W-+X2===2X-+W2
2Y-+W2===2W-+Y2 2X-+Z2===2Z-+X2,则反应2Z-+Y2===2Y-+Z2
也能自发向右进行
C.NO2―→NO必须加入还原剂才能实现
D.在一定条件下,分别以高锰酸钾、氯酸钾、H2O2为原料制取氧气,当制得同温、
同压下相同体积的氧气时,三个反应中转移的电子数之比为1∶1∶1
10.下列实验操作正确的是 ( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③实验室制硝基苯要把温度计插在烧杯热水的中部
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球上缘与蒸馏烧瓶支管口下缘相平
A.①④ B.③④⑥⑦ C.①③ D.②④⑤
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是 ( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
8.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:SnCl2+Cl-+H3AsO3+H+--As+SnCl+M(未配平),关于该反应的说法中正确的组合是 ( )
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成0.1 mol的As,还原剂失去的电子为0.3 mol
④M为OH-
⑤SnCl是氧化产物
⑥H+前面的配平系数为6
A.①③⑤⑥ B.①②④⑤ C.①②③④ D.只有①③⑥
7.在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是 ( )
A.Na+、SO、SO、K+ B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO、NO、Na+ D.K+、Ca2+、SO、Cl-
6.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差.李松同学通过实验得出的结论是m(H)∶m(O)>1∶8.下列对导致这一结果原因的分析中,一定不合理的是 ( )
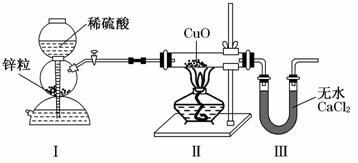
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中的CuO粉末可能不干燥
D.CuO没有全部被还原
5.配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是 ( )
A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度
C.定容时俯视刻度线
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
4.在某一澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH、Fe3+、Ba2+、
Al3+、SO、HCO、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有 ( )
A.4种 B.5种 C.6种 D.7种
3.下列实验设计和结论相符的是 ( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
2.NA代表阿伏加德罗常数.下列有关叙述正确的是 ( )
A.标准状况下,2.24 L H2O含有的分子数等于0.1NA
B.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数大于0.1 NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N-H键数目为0.2 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com