
21.已知: 与

“智能型”高分子,在生物工程中有广泛的应用前景。PMAA就是一种“智能型”高分子,可应用于生物制药中大分子和小分子的分离。下列是以物质A为起始反应物合成PMAA的路线:
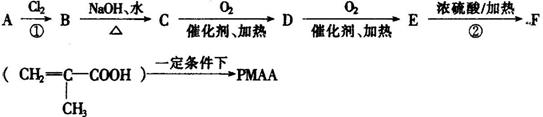
根据上述过程回答下列问题:
(1)分别写出A和PMAA的结构简式:A ,PMAA 。
(2)上述过程中①、②反应类型分别是:① 、② 。
(3)分别写出C→D和E→F的化学方程式:
C→D: ;
E→F: 。
(4)E在有浓硫酸和加热的条件下,除了能生成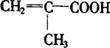 外还可能生成一种具有六元环的产物(用结构简式表示):
外还可能生成一种具有六元环的产物(用结构简式表示):
20.(14分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为___________________________________.
(2)某同学未加入其他物质,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
(3)在一定体积的18 mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积___________(填“>”“=”或“<”)100 mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?___________(填“可行”或“不可行”).
(4)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,一同学提出溶液呈“绿色”是原因是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:
______________________________________________________________________________________________________________________________________________________.
19.(6分)将一定质量的铁投入20 mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48 L(标准状况),剩余固体质量为6.6 g;则
(1)参加反应的铁的质量为 .
(2)硫酸溶液的物质的量浓度为 .
18.(10分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响? ;
(3)步骤②中发生反应的离子方程式为 、 .
17.(6分)现有以下物质:A:Na2O2 B:Al(OH)3 C:纯盐酸 D:CaClO·Cl
E:O3 F:HF G:Fe(OH)3胶体 H:液氨
(1)属于氧化物的是: (2)属于混合物的是:
(3)属于弱电解质的是: (4)属于非电解质的是:
(5)G的制备方法用离子方程式表示:
16.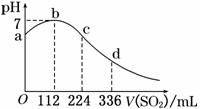 标准状况下,某同学向100
mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是 ( )
标准状况下,某同学向100
mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是 ( )
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
第Ⅱ卷(非选择题 52分)
15.有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)(mol/L)为 ( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
14.常温下,在密闭容器里分别充入两种气体各0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4.则原混合气体可能是 ( )
A.H2和O2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
13.下列离子方程式与所述事实相符且正确的是 ( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO+CO2+2H2O===Al(OH)3↓+HCO
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO+3Cl-+H2O+4H+
12. 下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com