
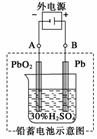
19.(10分)铅蓄电池是典型的可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
 Pb+PbO2+4H++2SO
Pb+PbO2+4H++2SO 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 ;
电解液中H2SO4浓度将变 ;电流方向从 极流向 极。当外电路通过1 mol电子时,理论上负极板的质量增加 g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成 、B电极上生成 ,此时铅蓄电池的正负极的极性将 。
答案 (1)PbO2+2e-+4H++SO
 PbSO4+2H2O 小
正 负 48
PbSO4+2H2O 小
正 负 48
(2)Pb PbO2 对换
18. (12分)银器皿日久表面会逐渐变成黑色,这是由于生成硫化银,有人设计用原电池进行“抛光”,其处理方法是:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失,试回答:
(12分)银器皿日久表面会逐渐变成黑色,这是由于生成硫化银,有人设计用原电池进行“抛光”,其处理方法是:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失,试回答:
(1)食盐的作用是 。
(2)在此原电池反应中,负极发生的电极反应为 ,
正极发生的电极反应为 。
(3)反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为 ,
原电池总反应方程式为 。
(4)实际操作中,配制食盐水时,通常还加入一定量的小苏打,其主要作用是 ,
这一反应的化学方程式是 。
答案 (1)作电解质起导电作用
(2)2Al-6e- 2Al3+
2Al3+
3Ag2S+6e- 6Ag+3S2-
6Ag+3S2-
(3)2Al3++3S2-+6H2O 2Al(OH)3↓+3H2S↑
2Al(OH)3↓+3H2S↑
 2Al+3Ag2S+6H2O
2Al+3Ag2S+6H2O 2Al(OH)3+3H2S↑+6Ag
2Al(OH)3+3H2S↑+6Ag
(4)除去生成的H2S,防止污染空气
H2S+NaHCO3 NaHS+H2O+CO2↑
NaHS+H2O+CO2↑
17.(12分)有四个电解池,分别放入0.1 mol/L的下列四种溶液:A.CuSO4 B.HCl C.AgNO3 D.KI,串联后用石墨电极电解一段时间,用序号填写能满足下列条件的溶液。
(1)阴极所析出的物质,其物质的质量最大的是 ;
(2)阳极无气体产生的是 ;
(3)阴、阳两极产生气体总量最大的是 ;
(4)溶液pH降低的是 。
答案 (1)C (2)D (3)B (4)AC
16.(9分)(2009·南通调研)已知:在热力学标准态(298 K、1.01×105 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH)。下图为氧族元素的氢化物a、b、c、d的生成热数据示意图。试完成下列问题:
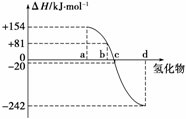
(1)写出氧族元素中含有18e-的两种氢化物的电子式 。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系 。
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学方程式: 。
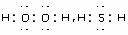
答案 (1)
(2)非金属元素氢化物越稳定,ΔH越小,反之亦然
(3)H2Se(g) Se(s)+H2(g);ΔH=-81 kJ·mol-1
Se(s)+H2(g);ΔH=-81 kJ·mol-1
15.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为2 221.5 kJ·mol-1,下列有关说法正确的是 ( )
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,丙烷为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g) 3CO2(g)+4H2O(g) ΔH=-2 221.5 kJ·mol-1
3CO2(g)+4H2O(g) ΔH=-2 221.5 kJ·mol-1
答案 A
14.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4 mol Fe(OH)3沉淀,此间共消耗水的物质的量为 ( )
A.8 mol B.10 mol
 C.11 mol D.12
mol
C.11 mol D.12
mol
答案 B
13.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是
( )
ZnO+2MnO(OH)。下列说法正确的是
( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为2MnO2+2e-+2H2O 2MnO(OH)+2OH-
2MnO(OH)+2OH-
答案 D
12.(2008·全国理综Ⅰ,13)电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是 ( )
A.0.10 mol/L Ag+ B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+
答案 C
11.已知:2H2(g)+O2(g) 2H2O(l);ΔH=-571.6 kJ·mol-1
2H2O(l);ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l);ΔH=-2 200 kJ·mol-1
3CO2(g)+4H2O(l);ΔH=-2 200 kJ·mol-1
 实验测得H2和C3H8的混合气共5 mol,完全燃烧时放出3 847 kJ热量,则混合气中H2与C3H8的体积比是 ( )
实验测得H2和C3H8的混合气共5 mol,完全燃烧时放出3 847 kJ热量,则混合气中H2与C3H8的体积比是 ( )
A.1∶3 B.3∶1
C.1∶4 D.1∶1
答案 B
10.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是 ( )
①原电池正极和电解池阳极所发生的反应 ②原电池正极和电解池阴极所发生的反应 ③原电池负极和电解池阳极所发生的反应 ④原电池负极和电解池阴极所发生的反应
A.①② B.①④
C.②③ D.③④
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com