
6.[2010年皖南八校第二次联考]2009年10月,中国散货轮“德新海”号在印度洋塞舌尔群岛遭遇索马里海盗袭击,有人研究发现这一地区在15世纪末也曾出现过一个著名的“海盗”,他是
A.迪亚士 B.达·伽马 C.哥伦布 D.麦哲伦
[解析]B 15世纪末到达这一地区的是达·伽马。迪亚士只到达好望角;哥伦布到达的是美洲,麦哲伦是16世纪才开始全球航行的。
5.[2010年南通第三次模拟考试]“基督教的理想是扩张的凝结剂,使各种各样世俗的要求罩上神圣的光圈,不管是到东方来的达·伽马还是到西方去的哥伦布,都是把宗教目标和现实目标糅合在一起,无法区分。”这段话表明新航路开辟中
A.宗教狂热成为探险家的精神动力 B.教皇发挥了组织作用
C.传播基督教是探险家的主要目的 D.教会蜕变成殖民机构
[解析]A 材料体现了传播基督教与开辟新航路的关系。传播宗教只是开辟新航路的精神动力,而非主要目的,更不能据此说明教会已经成为新航路开辟的组织者。新航路的开辟是葡萄牙、西班牙政府组织的,以掠夺财富为目的。随后开始的殖民扩张也是在殖民政府的组织下进行的。
4.(2010年江苏卷)英国曼彻斯特地区,在18世纪80年代初只有棉纺厂两家,短短的时间内棉纺厂发展很快:1802年52家,1809年64家,1830年99家,以上现象出现的主要原因是
A.珍妮纺纱机推动工业发展 B.蒸汽动力的普遍推广
C.铁路交通大规模兴建 D.英国棉纺品大量涌入中国
[解析]D 蒸汽机发明以后,解决了工业生产的动力问题,工场手工业作坊转变为机器大工业工厂。故正确答案为D。
3.(2010年全国卷1)19世纪上半叶,法国农村盛行一种“家庭加工系统”,即工厂本身或通过承包商把产品原料分给一些家庭加工,然后收回成品。这一现象说明在当时的法国
A.工业基于经济的多元结构 B.工业革命尚未开始
C.工业化带动农业经济转型 D.农村的劳动力过剩
[解析]A 19世纪上半叶,工业革命已经开始,故B错;CD与题干不符。
2.(2010年全国卷1)英国人麦考利1830年说:“如今我们国家比1790年还穷吗?我们坚决相信,尽管统治者有种种管理不当之处,但英国一直变得越来越富。有时略有停顿,有时暂时倒退,但总的趋势是不容置疑的。”这一说法的主要历史背景是
A.国际局势平稳发展 B.资本主义世界市场形成
C.工业革命成效显著 D.西方殖民主义体系确立
[解析]C A本身说法错误;从19世纪70年代到20世纪初-世界市场最终确立时期,故B错;19世纪末20世纪初西方殖民主义体系确立,故D错。
说明:本资料精选全国各地高考真题和全国新课标地区名校月考、联考、大市模拟试题,对备战2011年高考具有较好的指导作用。

1.(2010年天津卷)右图为首届世界博览会展馆。这届世博会反映了
①第一次工业革命的成果 ②西方列强对世界的掠夺
③英国的兴盛与强大 ④世界市场基本形成
A.①②③ B.①②④ C.①③④ D.②③④
[解析]C 此题要注意图片注释中的时间“1851年”,此时的英国工业革命已经完成,是当时世界上最强大的国家,而且世界市场已经基本形成。首届世博会的举办主要展现了英国工业文明的成果,说它反映了西方列强对世界的掠夺,于题意不符,可排除。
2.工业上制造金刚砂(SiC)的化学方程式如下:SiO2+3C SiC+2CO↑,在这个氧化还原反应中,氧化剂与还原剂物质的量之比是( ) A.1:2 B.2:1 C.1:1
D.3:5
3.CO2通入下列溶液中,不可能产生沉淀的是( )
A.氯化钙溶液 B.澄清石灰水 C.饱和Na2CO3溶液 D.硅酸钠溶液
4.在玻璃、水泥、炼铁工业生产中都需用到的原料是( )
A.石灰石 B.纯碱C.粘土D.石英
5.高岭土可表示为:Al2Si2Ox(OH)y,其中x、y和数值分别是( )
A.7、2 B.5、4 C.6、3 D.3、6
二、选择题本题包括10小题,每小题2分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.对ag纯净的Na2CO3和agNa2CO3与NaHCO3的混合物相比,下列各种情况的描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大 B.分别与足量盐酸反应时,混合物放出CO2多
C.分别配制成等体积溶液,混合物的pH大
D.分别配制成等体积溶液,混合物的Na+的物质的量浓度大
7.下列叙述中正确的是( )
A.SiO2属于无机非金属材料 B.金属不能作为结构材料
C.玻璃是一种新型的非金属材料 D.C60也是一种材料
8.某些化学试剂可用于净水,水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]]x,式中m等于( ) A.3-n B.6-n C.6+n D.3+n
9.将mgCaCO3与ngKHCO3分别加入100mL0.5mol/L盐酸中,若反应后两种溶液的质量相等,则m与n的关系是( ) A.m=n≤2.5 B.m=n>2.5 C.m=n≥5 D.m<n<2.5
10.取2.8g某元素的单质X在一定条件下与氧气充分作用,得到6g化合物XO2。该元素在周期表中的位置位于( ) A.第三周期 B.第二周期C.第ⅣA族 D.第VA族
11.下列溶液反应后,溶液内含有0.50molNaHCO3和0.50molNa2CO3的是( )
A.0.50L1.00mol/LNaHCO3加0.50L0.50mol/LNaOH
B.0.50L0.75mol/LNa2CO3加0.50L0.50mol/LHCl
C.0.50L1.00mol/LNaHCO3加0.50L0.25mol/LNaOH
D.1.00L1.00mol/LNa2CO3加1.00L0.50mol/LHCl
12.下列画有横线的反应物在反应中不能完全消耗的是( )
A.将含有少量CO2的CO通入足量的Na2O2并不断地用电火花引燃
B.向等物质的量的干冰和CaO的混合物中加几滴水
C.将1molCu置于含2molH2SO4的浓H2SO4中加热
D.在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量CO2
13.加热NaHCO3和Na2CO3·xH2O的混合物40g,至不再产生气体为止,得残留固体21.2g,把加热过程中产生的气体全部通入含有0.05molBa(OH)2溶液中,恰好使生成的沉淀完全消失,则x值为( )
A.6
B.7 C.9 D.10
14.下列属于新型无机非金属材料的特性的是( )
①能承受高温,强度高 ②具有电学特征 ③具有光学特性 ④具有生物功能 ⑤可塑性好
A.① B.①② C.①②③⑤ D.①②③④
15.下列材料的特性及用途叙述不正确的是( )
A.氧化铝陶瓷具有两性,可用来制造人造牙齿 B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维传导光的性能很强,是非常好的通讯材料 D.人造刚玉硬度高,用于制造刚玉球磨机
SiC+2CO↑,在这个氧化还原反应中,氧化剂与还原剂物质的量之比是( ) A.1:2 B.2:1 C.1:1
D.3:5
3.CO2通入下列溶液中,不可能产生沉淀的是( )
A.氯化钙溶液 B.澄清石灰水 C.饱和Na2CO3溶液 D.硅酸钠溶液
4.在玻璃、水泥、炼铁工业生产中都需用到的原料是( )
A.石灰石 B.纯碱C.粘土D.石英
5.高岭土可表示为:Al2Si2Ox(OH)y,其中x、y和数值分别是( )
A.7、2 B.5、4 C.6、3 D.3、6
二、选择题本题包括10小题,每小题2分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.对ag纯净的Na2CO3和agNa2CO3与NaHCO3的混合物相比,下列各种情况的描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大 B.分别与足量盐酸反应时,混合物放出CO2多
C.分别配制成等体积溶液,混合物的pH大
D.分别配制成等体积溶液,混合物的Na+的物质的量浓度大
7.下列叙述中正确的是( )
A.SiO2属于无机非金属材料 B.金属不能作为结构材料
C.玻璃是一种新型的非金属材料 D.C60也是一种材料
8.某些化学试剂可用于净水,水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH)nClm·yH2O]]x,式中m等于( ) A.3-n B.6-n C.6+n D.3+n
9.将mgCaCO3与ngKHCO3分别加入100mL0.5mol/L盐酸中,若反应后两种溶液的质量相等,则m与n的关系是( ) A.m=n≤2.5 B.m=n>2.5 C.m=n≥5 D.m<n<2.5
10.取2.8g某元素的单质X在一定条件下与氧气充分作用,得到6g化合物XO2。该元素在周期表中的位置位于( ) A.第三周期 B.第二周期C.第ⅣA族 D.第VA族
11.下列溶液反应后,溶液内含有0.50molNaHCO3和0.50molNa2CO3的是( )
A.0.50L1.00mol/LNaHCO3加0.50L0.50mol/LNaOH
B.0.50L0.75mol/LNa2CO3加0.50L0.50mol/LHCl
C.0.50L1.00mol/LNaHCO3加0.50L0.25mol/LNaOH
D.1.00L1.00mol/LNa2CO3加1.00L0.50mol/LHCl
12.下列画有横线的反应物在反应中不能完全消耗的是( )
A.将含有少量CO2的CO通入足量的Na2O2并不断地用电火花引燃
B.向等物质的量的干冰和CaO的混合物中加几滴水
C.将1molCu置于含2molH2SO4的浓H2SO4中加热
D.在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量CO2
13.加热NaHCO3和Na2CO3·xH2O的混合物40g,至不再产生气体为止,得残留固体21.2g,把加热过程中产生的气体全部通入含有0.05molBa(OH)2溶液中,恰好使生成的沉淀完全消失,则x值为( )
A.6
B.7 C.9 D.10
14.下列属于新型无机非金属材料的特性的是( )
①能承受高温,强度高 ②具有电学特征 ③具有光学特性 ④具有生物功能 ⑤可塑性好
A.① B.①② C.①②③⑤ D.①②③④
15.下列材料的特性及用途叙述不正确的是( )
A.氧化铝陶瓷具有两性,可用来制造人造牙齿 B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维传导光的性能很强,是非常好的通讯材料 D.人造刚玉硬度高,用于制造刚玉球磨机
第 Ⅱ 卷 (非选择题90分)
|
品 种 |
性 能 |
用 途 |
|
氧化铝陶瓷和单晶氧化铝 |
表面为亲水性,与生物体组织有良好的亲和性 |
人造骨、人造关节、接骨用螺钉 |
|
磷酸钙系陶瓷(磷灰石质陶瓷) |
类似于人骨和天然牙的性质、结构,可依靠从体液中补充Ca2+、PO43-等形成新骨,可在骨骼接合面产生分解、吸收和析出等反应,实现牢固结合 |
人造骨、人造关节、人造鼻软骨、穿此接头、人造血管、人造气管等 |
|
其他陶瓷(碳,CaO-P2O5-SiO2,Na2O系玻璃,微晶玻璃等) |
具有生物稳定性的碳有很好的生物体亲和性 |
人造心脏瓣膜、人造骨、人造牙等 |
课外拓展
1.“足球烯”发现小史和其超导性 1985年,美国科学家克罗托等用质谱仪,在严格控制实验条件,得到以C60为主的质谱图.由于受建筑学家布克米尼斯特·富勒设计的球形薄壳建筑结构的启发,克罗托等提出C60是由60个碳原子构成的球形32面体,即由12个五边形和20个六边形构成.其中五边形彼此不相连,只与六边形相连.每个碳原子以sp2杂化轨道和相邻的3个碳原子相连,剩余的p轨道在C60分子的外围和内腔形成键。随后将C60分子命名为布克米尼斯特·富勒烯.由于C60分子的结构酷似足球,所以又称其为足球烯。除C60外,具有封闭笼状结构的还可能有C28、C32、C50、C70、C84、……C240、C540等,统称为Fullerenes,中文译名为富勒烯。 1991年,赫巴德等首先提出掺钾C60具有超导性,超导起始温度为18K,打破了有机超导体(Et)2Cu[N(CN)2]Cl超导起始温度为12.8K的纪录。不久又制备出Rb3C60的超导体,超导起始温度为29K。我国在这方面的研究也很有成就,北京大学和中国科学院物理所合作,成功地合成了K3C60和Rb3C60超导体,超导起始温度分别为8K和28K。有科学工作者预言,如果掺杂C240和掺杂C540,有可能合成出具有更高超导起始温度的超导体。 2.活性炭的吸附性及其应用 木材干馏所得的固态产物是木炭,木炭由于它的孔隙被干馏时产生的油脂等物质所覆盖,吸附能力较弱,经活化处理增加表面积后就有高的吸附能力。这种具有高吸附能力的炭,称为活性炭。活性炭的孔隙多,内表面积大,一般为500m2/g-1000m2/g。活性炭属于非极性吸附剂,因此易吸附非极性或弱极性物质。常见的易被活性炭吸附的物质及应用如下: ①有毒的气体(或蒸汽):NO、NO2、Cl2、Br2、C6H6(苯),活性炭用于去毒、防毒; ②色素:活性炭用于溶液脱色(漂白),如制造白糖工业中可用活性炭做脱色剂; ③水中有臭味的物质:活性炭用于水的除臭净化。 3.硅胶及其应用 因为SiO2不溶于水,所以不能用SiO2与水直接反应来制取硅酸,而只能用可溶性硅酸盐的溶液与酸作用来制取,例如,Na2SiO3+2HCl=H2SiO3↓+2NaCl,硅酸的酸性比碳酸还弱。 硅酸的组成较复杂,随形成条件的不同而异,且在水中溶解度很小,在可溶性硅酸盐溶液中加入酸,开始生成组成简单的H2SiO3(常称为硅酸)或H4SiO4(称为原硅酸)并不立即沉淀下来,而以单分子形式存在于溶液中,但很快缩合为多硅酸,如H2SiO5、H6Si2O7、H4Si3O8等等,而形成硅酸溶胶(溶胶又称肢体溶液),如在此溶胶中再加入酸,可得软而透明且有弹性的硅酸凝胶(又称胨胶),如果原来所用的硅酸盐溶液浓度较大,则加酸(一般用盐酸或硫酸)时直接形成硅酸凝胶. 将硅酸凝胶静置24h使其老化,再用热水充分洗涤,洗净的凝胶在60-70℃烘干,并慢慢升温至300℃时活化,得到一种多孔性固体,称为“硅胶”,化学式用mSiO2·nH2O来表示,一般商品硅胶含H2O约3%-7%。 硅胶通常为半透明乳白色颗粒状固体,有很大的表面积,市售硅胶每克表面积可达300cm2-800cm2,孔径大小可达2-15nm。对于H2O、SO2、NH3等极性分子有较强的吸附作用,它不溶于水与一般强酸,但溶于氢氟酸或热的强碱溶液中。如果将硅酸凝胶用氯化钴(CoCl2)溶液浸泡后再烘干和活化,可制得蓝色的变色硅胶,当它吸水时会逐渐由蓝色变成红色,从颜色的变化可看出吸湿强度,从而考虑进行再生处理。硅胶是一种很好的干燥剂,吸湿量可达40%左右。它是良好的吸附剂和催化剂载体,广泛用于气体干燥、液体脱水、蒸气回收、石油的精炼等。 4.警惕陶瓷餐具中隐形杀手--铅 铅实际上是人体内的一种微量元素,不管人体哪部分含铅量高于正常值,都可能影响健康,铅被人体摄入的主要途径是呼吸和饮食,成年人吸收率为10%-30%,而儿童吸收率高于50%,所以儿童更容易受铅的伤害。铅被人体吸收后,只有少量被排出体外,绝大部分是累积在血液、软组织和骨骼、牙齿中,日积月累,使铅在某组织或血液中超过正常值,就可能出现铅中毒现象。 陶瓷餐具是人们饮食常用产品,其中有一种叫釉上彩陶瓷,因为画面装饰在瓷釉上面,所以叫釉上彩,面上的铅化合物能被酸渗解出来,当食物与画面接触时,铅就可能被食物中的有机酸渗出,人们食用这些食物时,铅即被摄入体内。国家对此标准做了严格规定,即陶瓷餐具有的铅渗量(规定用4%的醋酸渗的铅浓度为准)不得超过百万分之七(7ppm),而一些发达国家将铅渗出量控制在3ppm以下。 一般情况下,正规陶瓷生产企业,产品质量有保证,也有个别的陶瓷厂,由于生产工艺及检测手段不完善,产品中铅渗量容易超标。因此,消费者在选购陶瓷餐具时首先要区分一下选购的餐具是用什么方法装饰的。 白瓷(无任何装饰产品)、釉下彩瓷(装饰画面在釉下,为青花瓷)和釉中彩瓷(画面进入釉层,上有玻璃质覆盖),这几种装饰方法的产品,不存在铅污染,可放心选购。 釉上彩瓷很容易用目测和手摸的方法识别,凡画面不及釉面光亮,手感欠平滑甚至画面边缘有凸起感者,即为釉上彩资。这种装饰的方法的产品是否有铅污染问题,决定于画面所处的部位,如处于不与食物接触的部位(碗、杯、壶的外侧面),则不具备污染食物的条件,因而也放心选购;画面处于与食物接触的正面(如盘、碗正面的中央和边缘),这种产品就存在铅渗出是否超标的问题,消费者在选购时应慎重对待。 5.纳米材料研究的启迪 假使我们把制作玻璃、陶瓷、水泥、催化剂、电子元器件等的原料粒度研制到100nm-0.1nm尺度(纳米)范围,你能想像出,由此加工制出的材料或产品会出现哪些奇特性能吗?事实上,这些目前都已不是神话了,而是正在一件件展示在我们面前。20世纪末,纳米技术已成为材料科学研究的一个热点,科学家预言:“纳米左右和纳米以下的结构将是下一阶段科技发展的特点,会是一场技术革命,从而将是21世纪的又一次产业革命。” 早在20世纪60年代初,美国物理学家、著名诺贝尔奖获得者Feyneman就预言:如果对物体微小规模上的排列(如直接由人类按需排布原子)加以某种控制的话,物体就能得到大量的异乎寻常的特性,科学家的预言为后来提供了向科学进行的目标。到20世纪末,纳米技术已进入了异彩纷呈的时代:高硬度、高韧性、易加工的纳米陶瓷出现了;能执行各种功能的纳米电子器件研究频频告捷;可提高储存和信息处理能力上百万倍的生物分子计算机、可进入血液中的分子机器人已提上研究日程;能够对单原子进行操纵的技术SIM(扫描隧道显微镜)和AFM(原子显微镜)在分子组装方面正显示其独特的技能…… 请你想想:科学预言在科学技术发展历史上的作用是什么?“极限思维”在哪些方面会给人们带来好处?化学在纳米材料研究中充当什么角色? 6.玻璃态物质 玻璃态是介于结晶态和无定形态之间的一种物质状态。它的粒子不像晶体那样有严格的空间排列,但又不像无定形体那样无规则排列。有人把玻璃态形象地称为“短程有序,远程无序”,即从小范围看,它有一定的晶形排列,从整体看,却像无定形物质那样无晶形的排列规律。玻璃态物质没有固定的熔点,而是在某一温度范围内逐渐软化,变成液态。 7.各种“玻璃”的成分 (1)普通玻璃(Na2SiO3,CaSiO3,SiO2或Na2O·CaO·6SiO2) (2)石英玻璃(以纯净的石英为主要原料制成的玻璃,成分为SiO2) (3)钢化玻璃(与普通玻璃成分相同) (4)钾玻璃(K2O·CaO·6SiO2) (5)硼酸盐玻璃(SiO2,B2O3) (6)有色玻璃(在普通玻璃制造过程中加入一些金属氧化物:CuO--红色;CuO--蓝绿色;CdO--浅黄色;Co2O3--蓝色;Ni2O3--墨绿色;MnO2--紫色;胶体Au--红色;胶体Ag--黄色) (7)变色玻璃(用稀土元素的氧化物作为着色剂的高级有色玻璃) (8)变色玻璃(在普通的硼硅酸盐玻璃原料中加放少量对光敏感的物质,如AgCl,AgBr等,再加入极少量的敏化剂,如CuO等,使玻璃对光线变得更加敏感) (9)彩虹玻璃(在普通玻璃原料中加入大量氟化物、少量的敏化剂和溴化物制成) (10)防护玻璃(在普通玻璃制造过程中加入适当辅助料,使其具有防止强光、强热或辐射线透过而保护人身安全的功能,如灰色--重铬酸盐、氧化铁吸收紫外线和部分可见光;蓝绿色--氧化镍、氧化亚铁吸收红外线和部分可见光;铅玻璃--氧化铅吸收X射线;暗蓝色--重铬酸盐、氧化亚铁、氧化铁吸收紫外线、红外线和大部分可见光;加入氧化镉和氧化硼吸收中子流) (11)微晶玻璃(又叫结晶玻璃或玻璃陶瓷,是在普通玻璃中加入金、银、铜等晶体核制成,代替不锈钢和宝石,做雷达罩和导弹头等) (12)纤维玻璃(由熔融玻璃拉成或吹成的直径为几微米至几千微米的纤维,成分与玻璃相同) (13)玻璃丝(即长玻璃纤维) (14)玻璃钢(由环氧树脂与玻璃纤维复合而得到的强度类似钢材的增强塑料) (15)玻璃纸(用粘胶溶液制成的透明的纤维素薄膜) (16)水玻璃(Na2SiO3)的水溶液,因与普通玻璃中部分成分相同而得名 (17)金属玻璃(玻璃态金属,一般由熔融的金属迅速冷却而制得) (18)萤石(氟石)(无色透明的CaF2),用作光学仪器中的棱镜和透光镜 (19)有机玻璃(聚甲基丙烯酸甲酯,属于有机物)
碳族单元过关检测
可能用到的原子量: H:1 O:16 Na:23 K:39 Ca:40 S:32 Si:28 Ba:137 C:12
第 I 卷 (选择题共60分)
3HCO3+Al3+=Al(OH)3↓+3CO2↑
四、硅及其化合物的反应方程式
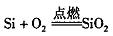 Si+2NaOH+H2O=Na2SiO3+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
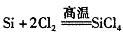 Si+4HF=SiF4+2H2↑
Si+4HF=SiF4+2H2↑
 SiO2+2NaOH=Na2SiO3+H2O
SiO2+4HF=SiF4↑+2H2O
SiO2+2NaOH=Na2SiO3+H2O
SiO2+4HF=SiF4↑+2H2O
 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
五、硅及其化合物的特性
(1)硅的晶体是良好的半导体材料。
(2)硅及其最高价氧化物SiO2的晶体为原子晶体。
(3)硅虽是非金属,但可与氢氟酸作用置换出氢气。
(4)硅可与强碱溶液反应生成H2,而其他非金属均不能发生此类反应。
(5)二氧化硅为酸性氧化物,它不仅可与碱及碱性氧化物反应生成相应的盐(通性),而且还可以与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O。
(6)硅酸盐是多种硅的盐的总称,而通常所说的某酸盐,为一种酸根的盐。
(7)绝大多数非金属元素的最高价含氧酸只有一种,称为某酸,少数还可失水后生成偏某酸,而硅的+4价含氧酸有许多种,如H4SiO4、H2SiO3、H2Si2O5、H6Si2O7等。
(8)Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3该反应由于H2CO3的酸性比H4SiO4强而得以进行,但SiO2在高温下与Na2CO3反应生成Na2SiO3和CO2,Na2CO3+SiO2
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
五、硅及其化合物的特性
(1)硅的晶体是良好的半导体材料。
(2)硅及其最高价氧化物SiO2的晶体为原子晶体。
(3)硅虽是非金属,但可与氢氟酸作用置换出氢气。
(4)硅可与强碱溶液反应生成H2,而其他非金属均不能发生此类反应。
(5)二氧化硅为酸性氧化物,它不仅可与碱及碱性氧化物反应生成相应的盐(通性),而且还可以与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O。
(6)硅酸盐是多种硅的盐的总称,而通常所说的某酸盐,为一种酸根的盐。
(7)绝大多数非金属元素的最高价含氧酸只有一种,称为某酸,少数还可失水后生成偏某酸,而硅的+4价含氧酸有许多种,如H4SiO4、H2SiO3、H2Si2O5、H6Si2O7等。
(8)Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3该反应由于H2CO3的酸性比H4SiO4强而得以进行,但SiO2在高温下与Na2CO3反应生成Na2SiO3和CO2,Na2CO3+SiO2 Na2SiO3+CO2↑,是CO2气体脱离反应体系才得以实现。
六、无机非金属材料分类
Na2SiO3+CO2↑,是CO2气体脱离反应体系才得以实现。
六、无机非金属材料分类
|
材 料 |
品种示例 |
|
|
传统无
机非金
属材料 |
水泥和其他胶凝材料 |
硅酸盐水泥、铝酸盐水泥、石灰、石膏等 |
|
陶 瓷 |
粘土质、长石质、滑石质和骨灰质陶瓷等 |
|
|
耐火材料 |
硅质、硅酸铝质、高铝质、镁质、铬镁质等 |
|
|
玻 璃 |
硅酸盐 |
|
|
搪 瓷 |
钢片、铸铁、铝和铜胎等 |
|
|
铸 石 |
辉绿岩、玄武岩、铸石等 |
|
|
研磨材料 |
氧化硅、氧化铝、碳化硅等 |
|
|
多孔材料 |
硅藻土、蛭石、沸石、多孔硅酸盐和硅酸铝等 |
|
|
碳素材料 |
石墨、焦炭和各种碳素制品等 |
|
|
非金属矿 |
粘土、石棉、石膏、云母、大理石、水晶和金刚石等 |
|
|
新型无
机非金
属材料 |
绝缘材料 |
氧化铝、氧化铍、滑石、镁橄榄石质陶瓷、石英玻璃和微晶玻璃等 |
|
铁电和压电材料 |
钛酸钡系、锆钛酸铅系材料等 |
|
|
磁性材料 |
锰-锌、镍-锌、锰-镁、锂-锰等铁氧体、磁记录和磁泡材料等 |
|
|
导体陶瓷 |
钠、锂、氧离子的快离子导体和碳化硅等 |
|
|
半导体陶瓷 |
钛酸钡、氧化锌、氧化锡、氧化钒、氧化锆等过滤金属元素氧化物系材料等 |
|
|
光学材料 |
钇铝石榴石激光材料,氧化铝、氧化钇透明材料和石英系或多组分玻璃的光导纤维等 |
|
|
高温结构陶瓷 |
高温氧化物、碳化物、氮化物及硼化物等难熔化合物 |
|
|
超硬材料 |
碳化钛、人造金刚石和立方氮化硼等 |
|
|
人工晶体 |
铝酸锂、钽酸锂、砷化镓、氟金云母等 |
|
|
生物陶瓷 |
长石质齿材、氧化铝、磷酸盐骨材和酶的载体材料等 |
|
|
无机复合材料 |
陶瓷基、金属基、碳素基的复合材料 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com