
2. 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50-60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,
最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,为什么要把浓硫酸慢慢注入浓硝酸中?
。
(2)步骤③中,为了使反应在50-60℃下进行,常用的方法是 ;
为什么硝化反应要控制在50℃-60℃? ;
温度计的作用及其水银球的位置如何? 。
(3)装置中常在试管上连接玻璃管,作用是什么? 。
(4)步骤④中洗涤、分离粗硝基苯应使用的仪器是 。
(5)步骤④中粗产品用5% NaOH溶液洗涤的目的是 。
(6)纯硝基苯是无色,密度比水 (填大或小),具有 气味的油状液体。
1.下图中A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答以下问题:
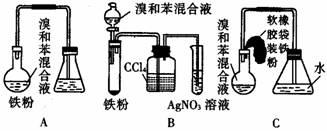
(1)写出三个装置中所共同发生的两个反应的化学方程式:
` 。
写出B的试管中所发生反应的化学方程式 。
(2)装置A和C均采用了长玻璃导管,其作用是 。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是
;应对装置C进行的操作是 。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是 。
(5)B中采用了洗气瓶吸收装置,其作用是 ,反应后洗气瓶中可能出现的现象是 。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是:
。
9.煤中含有硫,燃烧时会产生有害的SO2,用生石灰可以消除SO2,减少污染,其反应为
CaO(s)+SO2(s) == CaSO3(s)
298 K、1.01×1.01×105Pa时,此反应的△H== -402.0 kJ·mol-1,∆S== 345.7 J·mol-1·K-1,在室温下自发进行。则保持此反应自发进行的最高炉温是多少(焓变△H及熵变∆S受温度的影响可忽略)?
8.某化学反应其△H== -122 kJ·mol-1,∆S== 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
7.已知:298 K、1.01×105Pa下:
石墨:△H===0.0 kJ·mol-1、S== 5.74 J·mol-1·K-1;
金刚石:△H== 1.88 kJ·mol-1、S== 2.39 J·mol-1·K-1。
下列叙述中,正确的是 ( )
A.根据焓和熵的观点,石墨比金刚石稳定
B.根据焓和熵的观点,金刚石比石墨稳定
C.根据熵的观点,石墨比金刚石稳定,但根据焓的观点,金刚石比石墨稳定
D.根据焓的观点,石墨比金刚石稳定,但根据熵的观点,金刚石比石墨稳定
6.在25℃、1.01×105 Pa条件下,反应2N2O5(g)== 4NO2(g)+O2(g) ∆H== +56.7 kJ· mol-1能够自发进行。从能量上分析,生成物的总能量比反应物的总能量 ,从反应前后的熵值看,反应后的熵值 (填“增加”、“减小”或“不变”)。
[提高题]
5.下列热化学方程式中,放出的热量最多的是 ( )
A.CH4 (g)+2O2 (g) == CO2 (g)+2H2O (1) △H
B.2CH4 (g)+4O2 (g) == 2CO2 (g)+4H2O (1) △H
C.CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) △H
D.2CH4 (g)+4O2 (g) == 2CO2 (g)+4H2O (g) △H
4.已知反应2H2 (g) + O2 (g) == 2H2O (1) ∆H == 285.8 kJ·mol-1,下列结论中,正确的是 ( )
A.E(反应物)>E(生成物) B.E(反应物)<E(生成物)
C.反应放热 D.反应吸热
3.水在273 K、1.01×105Pa时可转化为固态,在373 K时则又可转化为气态。若分别用S(g)、S(1)、S(s)表示水的气、液、固三种状态的熵值,则下列表达式中,正确的是 ( )
A.S(g)<S(1)<S(s) B.S(g)>S(1)>S(s)
C.S(g)>S(1)= S(s) D.S(g)>S(s)>S(1)
2.下列物质中,熵值(S)最大的是 ( )
A.金刚石 B.Cl2(1) C.I2(g) D.Cu(s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com