
1.生产、生活离不开各种化学物质,下列说法不正确的是( )
A.二氧化硅是电子工业中常用的半导体材料
B.氢氧化铝可用于治疗胃酸过多
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.天然气、石油和煤均属于不可再生能源
例16、(09年福建卷)在一定条件下,Na2CO3溶液存在水解平衡:
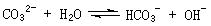 。下列说法正确的是
。下列说法正确的是
A. 稀释溶液,水解平衡常数增大 B. 通入CO2,平衡朝正反应方向移动
C. 升高温度,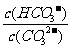 减小
D. 加入NaOH固体,溶液PH减小
减小
D. 加入NaOH固体,溶液PH减小
[解析]平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
[答案]B
例17、A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:

据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 .(用A、B、C字母填写)
(2)单质乙必定是 (填"金属"或"非金属"),其理由是 .
(3)单质乙的分子式可能是 ,则化合物B的分子式是 .
[解析]
(1) 根据题意,可转化为如下三个反应① 甲 + 乙→A,② 甲+B→ A + C, ③A + B→乙 + C,由①可知化合物A中一定含有乙元素,由②A中含乙元素,一定来源于化合物B,所以A、B均含有乙元素。
(2) 由③ 看出,该反应一定是氧化还原反应,乙为单质,A、B中又都含有乙元素,所以乙元素在A、B中必有一个显正价,另一个显负价。在中学化学中只有非金属元素显负价,因而乙一定是非金属元素。
(3) 单质乙可能是S,B的化学式H2S,A的化学式为SO2,因此可写出下列反应关系
也可认为乙是N2,也可以写出如下反应关系

[专题突破]
例15. (2008届创博智典联考题)中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:

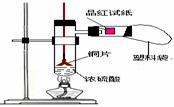
图1 图2
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
回答下列问题:
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
[解析]当铜片接触热浓硫酸时,有大量的白雾产生(白雾是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿,当品红试纸完全褪成白色后,把铜片向上提使其离开浓硫酸溶液,反应马上停止。
[答案](1)支管口有白雾,试管中出现绿色,品红试纸褪色,铜片部分溶解。
(2)收集多余的SO2气体,防止污染空气;
(3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体
SO2+2OH-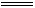 H2O+SO32-或SO2+OH-
H2O+SO32-或SO2+OH-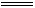 HSO3-
HSO3-
例13.(2007年上海)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
[解析]加入NaOH溶液加热后有气体产生,说明溶液中含NH4+;加足量BaCl2溶液后有沉淀产生,说明溶液中含CO32-或SO42-或CO32-、SO42-均有,经盐酸洗涤、干燥后,沉淀部分溶解,故CO32-、SO42-均有。因溶液中含CO32-、SO42-,故不含Mg2+、Ba2+;从实验(3)可见,溶液中含SO42-0.01mol,含CO32-0.02mol,从实验(2)得知,溶液中含NH4+0.04mol,故应还最少含K+0.02mol,Cl-可能存在也可能不存在。
[答案]AC
例14. 对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色 ②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝 ③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D.NH4+
[解析]①加热时放出的气体可以使品红褪色,则溶液中一定含有H2SO3,因H2SO3不稳定,分解产生的SO2可使品红褪色。②加碱后加热,产生使润湿的红色石蕊试纸变蓝的气体,即有NH3产生,说明溶液中一定含有NH4+。③加氯水时溶液显黄色,说明原溶液中含有Br-。再加BaCl2有白色不溶于HNO3的沉淀生成,说明此时溶液中含SO42-,但可能是原溶液含有的,也可能是氯水氧化H2SO3产生的,故不能确定的为SO42-。
[答案]B
例12. (1)将m g铁粉和n g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入____Lb mol·L-1的盐酸就不再产生气体。若把已放出的气体收集起来,在标准状况下的体积是______。
(2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。
[解析](1)由Fe+S FeS,FeS+2HCl
FeS,FeS+2HCl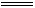 FeCl2+H2S↑,得Fe-2HCl;又由Fe+2HCl
FeCl2+H2S↑,得Fe-2HCl;又由Fe+2HCl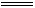 FeCl2+H2↑,得Fe-2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
FeCl2+H2↑,得Fe-2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
设加入b mol·L-1盐酸的体积为V,则
 ×2=V×b mol·L-1,得V=
×2=V×b mol·L-1,得V=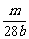 L或
L或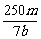 mL
mL
标准状况下产生气体的体积为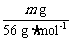 ×22.4 L·mol-1=0.4m L。
×22.4 L·mol-1=0.4m L。
(2)n(S)=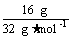 =0.05 mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L。
=0.05 mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L。
[答案](1)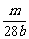 0.4m
L
0.4m
L
(2)与硫反应的铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成了铁的氧化物,与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L
例10.(09年全国2卷)下列徐树中正确的是
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
[解析]CaCO3与CO2反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量HCl反应时,放出的CO2多,C项错;D项,发生的反应为:Na2CO3 + CO2 + H2O =2NaHCO3↓,由于NaHCO3的溶解性较小,故有结晶析出,正确。
[答案]D
例11、(09年广东卷)下列说法都正确的是
① 江河入海口三角洲的形成通常与胶体的性质有关
② 四川灾区重建使用了大量钢材,钢材是合金
③ “钡餐”中使用的硫酸钡是弱点解质
④ 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
⑤ 常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键
⑥ 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
A. ①②③④ B. ①②④⑥ C. ①②⑤⑥ D. ③④⑤⑥
[解析]根据胶体的性质①正确;钢材是铁和碳的合金,②正确;“钡餐”是硫酸钡,但硫酸钡是强电解质,因为尽管硫酸钡是难溶物但溶于水的部分确实完全电离的 ③错;硅元素位于周期表第三周期第ⅣA主族,是处于金属与非金属的交界处,④正确;氯气是由非极性键组成的单质,⑤错;橡胶是高分子化合物,⑥正确。
[答案]B
例8.(09年全国2卷) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为
N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
[解析]设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3- ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
[答案]A
例9. 最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SARS病毒有直接抑制作用。下列关于NO的叙述正确的是( )
A.NO是一种红棕色的气体
B.常温常压下,NO不能与空气中氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO易溶于水,不能用排水法收集
[解析]NO是一种无色难溶于水的气体,可以用排水法收集。常温常压下,NO容易与氧气直接化合生成NO2。
[答案]C
例6.(09年福建卷) 能实现下列物质间直接转化的元素是
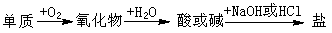
A. 硅 B. 硫 C. 铜 D. 铁
[解析]S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错。
[答案]B
例7.(09年广东卷) 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
[解析]结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
[答案]CD
例3.(2009届龙岩一中第一学段考试)下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的 ( )
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
[解析]氯水中存在H+,与NaHCO3反应产生CO2,与H+相关;氯水使红色布条褪色是因为氯水中存在HClO,而不是因为氯水中存在HCl;氯水中存在Cl2能氧化Fe2+→Fe3+,故滴加KSCN溶液,溶液呈血红色;氯水中存在Cl-能与AgNO3溶液生成白色沉淀。
[答案]B
例4.下列有关氯的叙述中正确的是
A.液氯和氯水是同一物质
B.红磷在氯气中燃烧产生白色烟雾
C.氯气与水的反应中氯是氧化剂,水是还原剂
D.用氯制漂白粉是为了得到易贮存的漂白剂
[解析]液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物,时间延长氯水中还逐渐生成盐酸和次氯酸,氯分子渐少,氯离子渐多。如果再有光照, 因分解也在渐少,出现氧气和更多盐酸。氯与水的反应是氯分子中氯原子间发生的自身氧化还原,即歧化反应, 水虽然是反应物,却未参加氧化还原。A、C不正确。
烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴。磷在氯气里燃烧的产物三氯化磷是无色液体,可发雾;五氯化磷是浅黄色固体,能形成烟。漂白粉和氯都可以作为漂白剂、消毒剂,且氯更有效。但氯气难贮存,又有剧毒,一般医用、家用的漂白剂和
消毒剂使氯气是不合宜的,所以制成漂白粉便于贮存和使用。漂白粉保存得当,如密闭,以防止吸水和 而变质,可以存放较长时间。B、D正确。
[答案]B、D。
例5. 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
|
|
卤素 |
氰 |
硫氰 |
① |
|
“单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
|
酸 |
HX |
HCN |
② |
HOCN |
|
盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、_______、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:______________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
[解析]此题主要考查“运用已学知识进行类推思维的能力”。解题时可用熟知的Cl2、HCl、KCl等物质作参照物。由还原性Br-<CN-<SCN-,可推知氧化性Br2>(CN)2>(SCN)2,因而可判断(CN)2只能与KSCN反应,不能与NaBr反应,亦即由物质的氧化性和还原性的强弱,可以判断氧化还原反应能否发生。
[答案]
(1)氧氰 HSCN KOCN
(2)①(CN)2+2KOH====KCN+KOCN+H2O
②(CN)2+2SCN-====2CN-+(SCN)2
例1.(09年全国1卷)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 。
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3 > PH3,因为前者中含有氢键后两者构型相同,分子间作用
力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可
[答案](1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
例2.(1)氰化钾、氰化氢的制备反应式为:
K2CO3+C+2NH3 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
氰离子为负一价(CN-),其中碳氮元素的化合价分别为________。 以上两个反应是否均为氧化还原反应?
(2)制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式。②为什么要磨细和用粉末?③为什么要强调适度加热?
[解析]据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS
 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS HCN↑+K2S。
HCN↑+K2S。
[答案]
(1)-3、①为氧化还原反应,②为非氧化还原反应。
(2)KCN+KHS HCN↑+K2S。 第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率.
HCN↑+K2S。 第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com