
24.(07年广东化学·25)(10分)
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-3。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-3。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强
E.加入催化剂
G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为 。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
答案:(10分)
(1)1.6×103L/mol 80%(计算过程略)
(2)B、C
(3)SO2+H2O+Na2SO3=2NaHSO3
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+
解析:难度,易。此题是比较中规中矩考查化学平衡知识的题目,题目条件比较直接,学生完成得应比较愉快。
23.(07年广东化学·22)(8分)
“碘钟”实验中,3I-+S2O42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A.<22.0s
B.22.0-44.0s
C.>44.0s
D.数据不足,无法判断
答案:(8分)
(1)研究反应物I-与S2O82-的浓度对反应速率的影响
(2)29.3s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析:难度,易。本题考查学生对影响化学反应速率的外界因素如浓度、温度及其规律的认识和理解,考查学生对图表的观察、分析以及处理实验数据归纳得出合理结论的能力。由题目中表格数据可分析出c(I-)、 c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响,因反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比),由①⑤中数据可列关系:显色时间t2=0.040·0.040·88.0/0.120·0.040=29.3 s,升高温度,反应速率加快,故显色时间t2<22.0s。07年广东高考在选择题方面减弱了考查,只有第18题的选项C、D中提到。在第二卷中也一改前二年的化学平衡图象题,改为化学反应速率的表格分析题,实际要求仍是考查学生运用所学化学反应速率与化学平衡思想解决指定问题的能力。
22.(09年海南化学·4) 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
答案:C
解析:题中有一明显的错误,就是C选项中平衡常数增大,增大压强不可能使平衡常数增大。其他选项均为平衡中的基础计算和基础知识,关键是根据表中数据(0.1-0.05)∶(0.2-0.05)∶(0.1-0)=1∶3∶2可推导出:X+3Y 2Z。
2Z。
21.(09年广东文基·68)下列说法正确的是
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
答案:C
解析:A项废旧电池应集中回收但不能填埋处理因为电池里的重金属会污染土地,人吃了这些土地里的蔬菜后,,就会引发疾病;B项充电电池放电时,化学能转变为电能;D项有的燃烧反应是需要吸收一定热量才可以反应的比如碳的燃烧。
[考点分析]垃圾的处理、电化学、影响化学反应速率因素、化学反应与能量。
19.(09年山东理综·14)2SO2(g)+O2(g)
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,SO3(g)生成的平均速率为

答案:D
解析:催化剂可以同等程度的改变正逆反应的反应速率;如果是通入惰性气体增大了体系压强,反应物浓度未变,反应速率不变;降温,反应速率减慢,达到平衡的时间增大;D是反应速率的定义,正确。
20 .(09年天津理综·5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
.(09年天津理综·5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
 A.CO与HbO2反应的平衡常数K=
A.CO与HbO2反应的平衡常数K=
 B.人体吸入的CO越多,与血红蛋白结合的O2越少
B.人体吸入的CO越多,与血红蛋白结合的O2越少
 C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
 D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
 答案:C
答案:C
解析:由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K= ,由题意知,K=220,
,由题意知,K=220, =0.02时,人受损,则c(CO)/c(O2)=9×10-5,C项错。D项,当O2浓度很大时,题中平衡将逆向移动,从而解救人,正确。
=0.02时,人受损,则c(CO)/c(O2)=9×10-5,C项错。D项,当O2浓度很大时,题中平衡将逆向移动,从而解救人,正确。
18.(09年宁夏理综·13)在一定温度下,反应H2(g)+X2(g) HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
答案:B
解析:1/2H2(g)+ 1/2X2(g)  HX(g)的平衡常数K1为10,那么HX(g)
HX(g)的平衡常数K1为10,那么HX(g)  1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10,
2HX(g)
1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10,
2HX(g)  H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有,
2HX(g)
H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有,
2HX(g)  H2(g)+
X2(g)
H2(g)+
X2(g)
1 0 0
x x x
1-x x x
K3= x·x/(1-x) 2= 0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
[点评]本题考查化学平衡常数的相关计算,题目难度不大,但要求考生平时要掌握方程式的变化对于化学平衡常数表达式的影响和数值的改变。
17.(09年宁夏理综·10)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
答案:D
解析:影响化学反应速率的因素众多,本题从浓度和和温度两个因素考查,非常忠实于新教材必修2,只要抓住浓度越大,温度越高反应速率越大,便可以选出正确答案D。
[点评]本题主要考查影响化学反应速率的因素,题目来源于课本,考生很有亲切感。
15.(09年广东理基·29)已知汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
答案:A
解析:升高温度、使用催化剂都会使化学反应速率升高,既包括正反应速率也包括逆反应速率,故A选项错误,B选项正确。反应达到平衡后,正反应速率和逆反应速率相等,因此C、D选项都是正确的。
 16
16 .(09年江苏化学·14)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
.(09年江苏化学·14)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)
I3-(aq)
 某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是

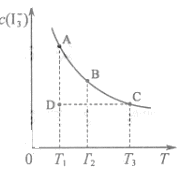
A.  反应 I2(aq)+I-(aq)
反应 I2(aq)+I-(aq) I3-(aq)的△H>0
I3-(aq)的△H>0
 B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
 C.若反应进行到状态D时,一定有v正>v逆
C.若反应进行到状态D时,一定有v正>v逆
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
 答案:BC
答案:BC
 解析:随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以△H<0,所以A项错;因为K=
解析:随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以△H<0,所以A项错;因为K= ,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时I3-的浓度在增加,所以v正>v逆,C项正确;D项,从状态A到状态B,I3-的浓度在减小,那么I2的浓度就在增加。
,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时I3-的浓度在增加,所以v正>v逆,C项正确;D项,从状态A到状态B,I3-的浓度在减小,那么I2的浓度就在增加。
 [考点分析](1)
[考点分析](1) 化学平衡的移动;(2)平衡常数的运用。
化学平衡的移动;(2)平衡常数的运用。
14.(09年广东化学·15)取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

答案:BD
解析:在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
13.(09年广东化学·7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2 (g)
TaS2 (s)+2I2 (g) 
 TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
下列说法正确的是
A.在不同温度区域,TaI4 的量保持不变
B.在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
答案:C
解析:高温区TaS2反应生成TaI4气体至低温区,从而在低温区重新生成TaS2,一段时间后,杂质留在高温区,TaS2在低温区,从而达到分离效果。不同温度下反应的方向不同,TaI4的量与温度高低有关并非保持不变,A错误;因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误,C正确。平衡常数与TaI4和S2的浓度乘积成正比,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com