
2.根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)0.1/22=1/220mol
1.70至90S,CO2生成的质量为:m(CO2)0.95-0.85=0.1g
31.(11分)(08年广东化学·20)
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:

依据反应方程式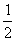 CaCO3+HNO3=
CaCO3+HNO3=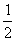 Ca(NO3)2+
Ca(NO3)2+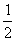 CO2↑+
CO2↑+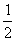 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
答案:(1)
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol-1·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅱ)③ (Ⅲ)④ |
|
② |
298 |
粗颗粒 |
1.00 |
|
|
③ |
308 |
粗颗粒 |
2.00 |
|
|
④ |
298 |
细颗粒 |
2.00 |
(2)
70至90s内,CO2生成的质量为:m(CO2)=0.95 g-0.84 g=0.11g,其物质的量为n(CO2)=0.11g÷44g·mol-1=0.0025mol,
根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)=0.0025mol×2==0.005mol,
溶液体积为25mL=0.025L,所以HNO3减少的浓度△c(HNO3)=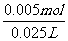 =0.2mol·L-1,
=0.2mol·L-1,
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)== =0.01mol·L-1·s-1。
=0.01mol·L-1·s-1。
(3)

解析:
(1)
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
⑴实验①和②探究HNO3浓度对该反应速率的影响; ⑵实验①和③探究温度对该反应速率的影响。 ⑶实验①和④探究大理石规格(粗、细)对该反应的影响。 |
|
② |
298 |
粗颗粒 |
1.00 |
|
|
③ |
308 |
粗颗粒 |
2.00 |
|
|
④ |
298 |
细颗粒 |
2.00 |
(2)
30.(14分)(08年宁夏理综·25)
已知可逆反应:M(g)+N(g) P(g)+Q(g),△H>0
P(g)+Q(g),△H>0
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1,
c(N)=2.4 mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ;
(4)若反应温度不变,反应物的起始浓度为:c(M)= 1 mol·L-1,达到平衡后,M的转化率为 。
答案:(14分)
(1)25% (2)增大 (3)6 (4)41%
解析:(1)M转化的物质的量为0.6mol·L-1,则N反应的量也是0.6mol·L-1,所以N的转化率为:×100%=25%。
(2)由于该反应的正反应为吸热反应,所以升高温度,化学平衡正向移动,M的转化率增大。
(3) M(g)+N(g)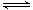 P(g)+Q(g)
P(g)+Q(g)
起始:1 2.4 0 0
平衡:0.4 1.8 0.6 0.6
起始:4 a 0 0
平衡:2 a-2 2 2
= ,a=6mol·L-1。
(4) = ,x=0.41b,M的转化率为41%。
9.8×109g x y
则 ,解得x=8.0×103t y=9.83×109kJ。
,解得x=8.0×103t y=9.83×109kJ。
29.(07年宁夏理综·31A)化学选考题(15分)
A.[化学-选修化学与技术]
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1) 已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
答案:(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应。(2)增大压强对提高SO2转化率无显著影响,反而会增加成本。(3)否 否 (4)浓硫酸 (5)8.0×103t 9.83×109kJ
解析:(1)根据表格中的数据可以看出,在相同压强下(如在0.1MPa下)升高温度(如由400℃升高到500℃)时SO2的转化率降低(由99.2%降低为93.5%),即升高温度时此化学平衡向逆反应方向移动,而升高温度化学平衡应该向吸热反应方向移动,所以此反应的正反应为放热反应。
(2)根据表格中的数据可以得知:在0.1MPa(即常压1atm下)SO2的转化率已经很高,如在400℃时已达99.2%,若增大压强到10MPa(即100atm),压强增大了100倍但是SO2的转化率值增大为99.9%,只增大了0.7%变化不大。而压强增大100倍,需要对设备的材料、动力、能源等都作相应的提高,既要增大成本投入。
(3)使用催化剂只能改变化学反应的速率,改变反应到达平衡的时间,不能使化学平衡发生移动,即对SO2的转化率不产生影响;而在一定条件下,化学反应放出的热量与参加反应的反应物的量成正比,因SO2的转化率不变,所以反应放出的热量也不会增大。
(4)在生产实际中是采用98.3%的浓硫酸作吸收剂来吸收SO3的。因为若用水进行吸收会形成酸雾,将影响SO3的吸收速率和效率。
(5)1万吨98%的硫酸含H2SO4的质量:9.8×109g。 设需要SO3的质量为x,该反应产生的热量为y。
H2SO4 - SO3 - 放出的热量
98g 80g 196.9kJ
28.(07年宁夏理综·27)(14分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2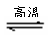
 Si3N4 + CO
Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol·L-1·min-1,
则N2消耗速速率为v(N2)= mol·L-1·min-1。
答案:(1)3 6
2 1 6 (2)N2 Si3N4 (3) (或
(或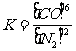 )
)
(4)小于 减小 (5)逆 (6)6
解析:(1)利用观察法配平或利用氧化还原反应中的电子守恒来配平。配平后的化学方程式为3SiO2
+6C+2N2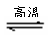
 Si3N4
+ 6CO。
Si3N4
+ 6CO。
(2)分析各物质的化合价变化情况:C元素由0价升高为+2价,在反应中作还原剂被氧化;N元素的化合价由0价降低为-3价,在反应中作氧化剂被还原。因此,此反应的氧化剂为N2,还原产物为Si3N4。
(3)因SiO2、C、Si3N4均为固体,只有N2和CO为气体,存在平衡浓度(或平衡分压),因此根据化学平衡常数的表达式可以得出此反应的平衡常数表达式为 或
或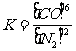 。
。
(4)放热反应的焓变△H<0,升高温度,此平衡向左移动,使[CO]减小、[N2]增大,因此平衡常数K值减小。
(5)由于此反应的正反应为气体体积增大的反应,因此增大压强,此平衡将向逆反应方向移动。
(6)根据同一反应在同一时间段内,各物质的反应速率之比等于各物质在化学方程式中对应的计量数之比。则有 ,所以v(N2)=
,所以v(N2)=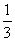 v(CO)=
v(CO)=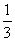 ×18mol·L-1·min-1=6mol·L-1·min-1。
×18mol·L-1·min-1=6mol·L-1·min-1。
27. (07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(07年山东理综·28)(11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
 若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
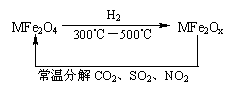
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni=由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
答案:(1)①800L·mol-1 ②= (2)1.60NA(或1.6NA) 173.4 (3)MFe2Ox+SO2→MFe2O4+S
解析:(1)据题意当容器中总压强为0.10MPa时,SO2的平衡转化率为0.80,据此可计算得出平衡时c(SO2)=0.040mol·L-1;c(O2)=0.020mol·L-1;c(SO3)=0.16mol·L-1。根据平衡常数的计算式:K=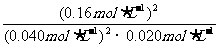 =800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
=800L·mol-1;只要温度不变,平衡常数就不改变,在此变化过程中,只有压强的改变,温度未发生变化,故K(A)=K(B)。
(2)用标准状况下4.48LCH4还原NO2 至N2,4.48LCH4的物质的量为0.20mol,在此过程中CH4中碳元素的化合价有-4价升高到+4价,转化为CO2,失去电子的总物质的量为0.20mol×8= 1.60mol,故转移电子数为1.60NA。由题目给知的热化学方程式,根据盖斯定律可以得出CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1,则0.2molCH4反应放出的热量为867 kJ·mol-1×0.2mol=173.4kJ。
(3)此题中反应物已知为MFe2OX和SO2,反应后生成MFe2O4,由MFe2OX转化为MFe2O4,氧原子数增加,故SO2失去氧原子转化为S,反应式为:MFe2OX+SO2=MFe2O4+S。
26.(9分)(2007海南·17)下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
C(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
答案:(1)固体反应物的表面积 表面积越大 1和2
(2)3和4(3)开始反应温度 6和7
(4)一定量的金属跟足量的硫酸反应放出的热量相同
考点:本题考查了通过处理实验数据研究化学反应速率的影响因素。
解析:比较表中实验1和2、实验4和5,其他条件都一样,只是金属状态由丝变成了粉末,金属消失的时间就少了很多,反应速率变快很多,也就是说明金属固体的表面积越大,速率就越快。同理,比较表中各项数据进行分析不难得出正确答案。
25.(6分)(2007海南·16)PCl5的热分解反应如下:
PCl5(g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
(1) 写出反应的平衡常数表达式;
(2) 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。
答案:(1)K==
(2)
PCl5(g) PCl3(g)
+ Cl2(g)
PCl3(g)
+ Cl2(g)
c(起始)(mol/L) =0.200 0 0
c(变化)(mol/L) 0.150 0.150 0.150
c(平衡)(mol/L) 0.050 0.150 0.150
所以平衡常数K====0.45
考点:本题考查了化学平衡常数的求算。
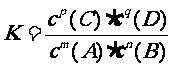 解析:对于反应: mA + nB
解析:对于反应: mA + nB  pC
+ qD
1、定义: 在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。
2.数学表达式:
平衡常数的数学表达式
pC
+ qD
1、定义: 在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂之积与反应物平衡浓度的幂之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。
2.数学表达式:
平衡常数的数学表达式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com