
1. 若命题“ ”与命题“
”与命题“ 或
或 ”都是真命题, 那么命题
”都是真命题, 那么命题 一定是
. 命题 (填写
一定是
. 命题 (填写
“真”或“假”)
2.根式的运算性质:
①当n为任意正整数时,(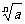 )
) =a.
=a.
②当n为奇数时, =a;当n为偶数时,
=a;当n为偶数时, =|a|=
=|a|= .
.
⑶根式的基本性质: ,(a
,(a 0).
0).
1.根式的概念;
例1(课本第71页 例1)求值
① = -8 ;
= -8 ;
② = |-10| =
10 ;
= |-10| =
10 ;
③ = |
= | | =
| =  ;
;
④ = |a- b| =
a- b .
= |a- b| =
a- b .
去掉‘a>b’结果如何?
例2求值:

分析:(1)题需把各项被开方数变为完全平方形式,然后再利用根式运算性质;
 解:
解:



1.根式:
⑴计算(可用计算器)
① = 9 ,则3是9的平方根 ;
= 9 ,则3是9的平方根 ;
② =-125 ,则-5是-125的立方根 ;
=-125 ,则-5是-125的立方根 ;
③若 =1296 ,则6是1296 的 4次方根 ;
=1296 ,则6是1296 的 4次方根 ;
④ =693.43957 ,则3.7是693.43957的5次方根 .
=693.43957 ,则3.7是693.43957的5次方根 .
⑵定义:
一般地,若 则x叫做a的n次方根
则x叫做a的n次方根
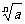 叫做根式,n叫做根指数,a叫做被开方数
叫做根式,n叫做根指数,a叫做被开方数
例如,27的3次方根表示为 ,-32的5次方根表示为
,-32的5次方根表示为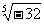 ,
, 的3次方根表示为
的3次方根表示为 ;16的4次方根表示为!
;16的4次方根表示为! ,即16的4次方根有两个,一个是
,即16的4次方根有两个,一个是 ,另一个是-
,另一个是- ,它们绝对值相等而符号相反.
,它们绝对值相等而符号相反.
⑶性质:
①当n为奇数时:正数的n次方根为正数,负数的n次方根为负数
记作: 

②当n为偶数时,正数的n次方根有两个(互为相反数)
记作: 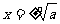

③负数没有偶次方根,
④ 0的任何次方根为0
注:当a 0时,
0时,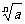
 0,表示算术根,所以类似
0,表示算术根,所以类似 =2的写法是错误的.
=2的写法是错误的.
⑷常用公式
根据n次方根的定义,易得到以下三组常用公式:
①当n为任意正整数时,(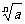 )
) =a.例如,(
=a.例如,( )
) =27,(
=27,(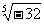 )
) =-32.
=-32.
②当n为奇数时, =a;当n为偶数时,
=a;当n为偶数时, =|a|=
=|a|= .
.
例如, =-2,
=-2, =2;
=2; =3,
=3, =|-3|=3.
=|-3|=3.
⑶根式的基本性质: ,(a
,(a 0).
0).
注意,⑶中的a 0十分重要,无此条件则公式不成立. 例如
0十分重要,无此条件则公式不成立. 例如 .
.
用语言叙述上面三个公式:
⑴非负实数a的n次方根的n次幂是它本身.
⑵n为奇数时,实数a的n次幂的n次方根是a本身;n为偶数时,实数a的n次幂的n次方根是a的绝对值.
⑶若一个根式(算术根)的被开方数是一个非负实数的幂,那么这个根式的根指数和被开方数的指数都乘以或者除以同一个正整数,根式的值不变.
3.注意
①
 可看作
可看作 ∴
∴ =
= =
=

②
 可看作
可看作 ∴
∴ =
= =
=

2.运算性质:
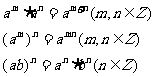

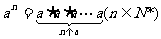
1.整数指数幂的概念



4、 叫做中和热。
试题枚举
[例1]已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
解析:化学反应中的能量变化,通常主要表现为热量的变化--吸热或放热,当反应物的总能量高于生成物质总能量时为放热反应中,当反应物的总能量低于生成物的总能量时为吸热反应。值得注意的是:总能量是指所有反应物或所有生成物,而不是其中某些反应物或某些生成物,所以A、B是不正确的;而有的放热反应在开始时也是需要加热的,例如炭的燃烧。
答案:C
[例2]关于吸热反应的说法正确的是( )
A.凡需加热的反应一定是吸热反应 B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
解析:A组见上一题目分析,有些化合反应也是吸热反应,例如炭和二氧化碳化合生成一氧化碳的反应就是吸热反应,故B不正确,催化剂是用来改变化学反应速率的,它不能改变反应物和生成自身的能量,故不影响反应热,像合成氨、二氧化硫的催化氧化都是放热反应,故C也是不对的。CO2和CaO的化合反应与CaCO3的分解反应是相反过程,故D正确。
答案D
[例3]下列反应属于吸热反应的是( )
A.Ba(OH)2•8H2O晶体和NH4Cl混合搅拌 B.盐酸和氢氧化钠混合
C.锌放入稀硫酸中 D.焦炭和水蒸气高温下反应
解析: 酸与碱的中和反应、金属与酸的反应都是放热反应。
答案:AC
[变式]下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
答案:C
[例4]在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H - H键要吸收436KJ的能量,断裂1mol Cl- Cl键要吸收243KJ的能量,断裂1molH-Cl键要吸收432KJ的能量,则在氯气中充分燃烧1mol H2 的能量变化是 。
解析: 在氯气中充分燃烧1mol H2 时,要先破坏1mol的H-H键和1mol的Cl-Cl键,此过程是需要吸收679kJ的能量;在氯气中充分燃烧1mol H2 时会形成2molH-Cl,放出864KJ的能量,吸收和放出能量相抵,仍会放出185KJ的能量。
答案:185kJ
[变式]把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)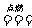 CO2(g) (
放热Q1 kJ )
CO2(g) (
放热Q1 kJ )
途径Ⅱ:先制水煤气
C(s)+H2O(g) == CO(g)+H2(g) (吸热Q2 kJ)
再燃烧水煤气

|
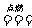 2CO2(g)
2CO2(g)
2H2(g)+O2(g) 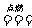 2H2O(g)
2H2O(g)
试回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是__________________。
(3)由于制取水煤气反应里,反应物所具有的总能量________生成物所具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为______ 。
(4)简述煤通过途径Ⅱ作为燃料的意义:
[答案](1)等于 (2)Q1 = Q3 - Q2 (3)低于 吸收 高温
(4) 固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送 。
3.化学反应中物质的化学能除了转变为热能,还可以转变为电能,那么请问:什么样的化学反应中的化学能才能转变为电能呢?又是如何转化的?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com