
2.下列各组词语中,没有错别字的一组是( )
A.眩晕/ 光彩炫目 重叠/ 高潮迭起 心酸/ 人间辛酸
B.心率/ 心律不齐 掠夺/ 攻城掠地 陈规/ 墨守成规
C.轻闲/ 清闲自在 再世/ 再所不辞 青山/ 山清水秀
D.法治/ 法制社会 绿阴/ 绿草如茵 直言/ 仗义执言
1.下列词语中加点的字,每对读音都不相同的一项是( )
A.媲美/譬喻 回溯/塑料 花圈/圈养 贩卖/皈依
B.骨髓/随意 盘桓/城垣 模样/模仿 悲恸/恫吓
C.纨绔/ 胯下 市侩/杂烩 强迫/倔强 油炸/札记
D.痉挛/靓妆 噱头/戏谑 横财/ 蛮横 档案/当铺
23.(12分)如下图装置中, b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
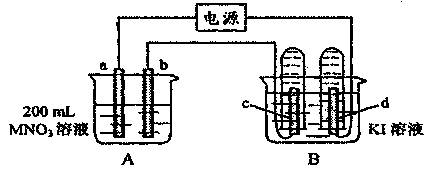 (1)a为
极,c极的电极反应式为
。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8 mL气体(标准状况)时停止电解,a极上放出了
mol气体,若b电极上沉积金属M的质量为0.432
g,,则此金属的摩尔质量为
。
(1)a为
极,c极的电极反应式为
。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8 mL气体(标准状况)时停止电解,a极上放出了
mol气体,若b电极上沉积金属M的质量为0.432
g,,则此金属的摩尔质量为
。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200 mL,取这种溶液加入到 25.0 mL 0.100 mol·L-1 HCI溶液中,当加入31.25 mL溶液时刚好沉淀完全。试计算:电解前A烧杯中MNO3溶液的物质的量浓度。
 安化一中2010年上学期期末考试
安化一中2010年上学期期末考试
23.(9分)
Ⅰ.(1)用已知浓度的盐酸滴定未知浓度的NaOH溶液,选用酚酞作指示剂,下列操作会导致测定结果偏低的是 ( )
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取标准液读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
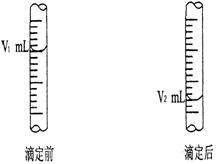 (2)现用物质的量浓度为a mol/L的标准盐酸去测 定V mL NaOH溶液的物质的量浓度,下图是酸式滴定管中液面在滴定前后的读数:则c (NaOH) = _______________。
(2)现用物质的量浓度为a mol/L的标准盐酸去测 定V mL NaOH溶液的物质的量浓度,下图是酸式滴定管中液面在滴定前后的读数:则c (NaOH) = _______________。
Ⅱ.甲、乙两个同学同时设计了一份表格,用于酸碱中和滴定实验的数据记录和处理。甲同学设计的表格和实验记录结果如下:
|
次数 |
V(NaOH)/mL |
V(HCl)/mL |
|
1 |
20.48 |
22.46 |
|
2 |
25.00 |
21.98 |
|
3 |
25.00 |
22.36 |
乙同学设计的表格和实验记录结果如下:
|
次数 |
V(NaOH)/mL |
V(HCl)/mL |
||||
|
始读数V1 |
终读数V2 |
V2-V1 |
始读数V1′ |
终读数V2′ |
V2′-V1′ |
|
|
1 |
0.10 |
25.00 |
|
0.00 |
24.80 |
|
|
2 |
0.00 |
24.80 |
|
0.10 |
22.32 |
|
|
3 |
0.00 |
24.80 |
|
0.00 |
24.70 |
|
请回答下列问题:
(1)你认为甲、乙两同学设计的表格哪个比较合理 (填“甲”或“乙”),你判断的依据是 。
(2)分析你在(1)中选择的表格中的实验数据[若c(HCl)=0.10 mol·L-1 ],则测得的c(NaOH)= mol·L-1。
22、(共8分)
(1)、(2分)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为: ______
(2)、(2分)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ________
(3)、(2分) 把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为: ___________________
(4)、(2分)写出NaHCO3溶于水后的电离方程式: __________________
21.(7分)已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)
△H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关
N2O4(g)
△H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关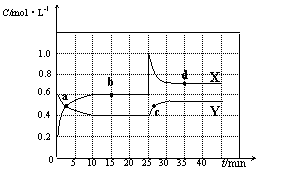 系如下图所示。
系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度 随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
②反应2NO2(g)  N2O4(g)在b点平衡常数的表达式是K(b)=
。
N2O4(g)在b点平衡常数的表达式是K(b)=
。
③反应2NO2(g) 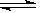 N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
20.(10分)在常温下,下列五种溶液:①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③ 0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;由水电离出c(H+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1 mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度____(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
18、已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
A.加少量CH3COONH4固体 B.降低温度
C.加少量NaOH固体 D.升高温度
Ⅱ卷
17、右图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是
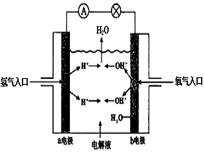 A.a电极是阴极
A.a电极是阴极
B.b电极的电极反应为:4OH--4 e-=2H2O +
O2
C.电池工作时,电子由正极通过外电路流向负极
D.氢氧燃料电池是一种具有应用前景的绿色电
源
16、在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是
A. 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- B. pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- C. 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ D. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com