
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
29.(每空3分,共15分)根据下框图关系,完成下列问题:

H(白色↓)不溶于盐酸,A、B都是酸式盐。
(1)工业生产D的典型设备是 ,工业生产F选择的条件是
(2)石墨电极电解C溶液时阳极的电极方程式是
(3)B溶液中加入I溶液反应恰好显中性时的离子方程式为
(4)B溶液与A溶液反应的离子方程式为
30.(每空2分,共16分)
A、B、C、D、E、X 都是短周期元素组成的常见无机物

根据上框图关系,完成下列问题:
(1)A可作漂白剂,X是含有某种阳离子(此阳离子具有净水作用)的溶液,且M(A)=M(D),
则A与H2O反应的化学方程式为 ,C转化成D的离子方程式为
(2)A的某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为 ,C转化成D的化学方程式为
(3)A是单质,X是Na2CO3溶液,E可用消毒剂,则A与H2O反应的离子方程式为
,
(4)A是单质,X是单质(它的同素异形体是原子晶体),则E与SiO2反应的化学方程式为
(5)A是化合物,X是O2,C转化成D还需要催化剂,E具有两性,则A与H2O反应的化学方程式为
(6)A是化合物(Mr(A)=100),X是O2,B转化成C还需要催化剂,E是中强碱,则A
与H2O反应的化学方程式为
31.请回答:[(8分)
(1)葡萄糖由肠腔进入小肠上皮细胞需要 蛋白的协助并消耗能量,
小肠上皮细胞对葡萄糖的吸收属于 的过程。
(2)小肠上皮细胞中的葡萄糖浓度比血液中的高,葡萄糖由上皮细胞进入血液,驱动该转运过程的动力来自 。
(3)正常人体的血糖含量为80-120mg/dL,机体长时间运动时,血糖不断被消耗,此时胰岛细胞分泌的 增加,该分泌物可促进机体内的 分解,使血糖含量维持在正常水平,在该调节过程中与该分泌物具有协同作用的激素是
。
(4)当血糖浓度高于160-180mg/dL时,部分葡萄糖随尿液排出体外。该过程影响肾脏对水的重吸收从而导致 增多,此时收集尿液并加入班氏试剂,经加热后尿液颜色呈 。[来源
32.(15分)人类在预防与诊疗传染性疾病过程中,经常使用疫苗和抗体。已知某传染性疾病的病原体为DNA病毒,该病毒表面的A蛋白为主要抗原,且菌苗生产和抗体制备的流程之一如下,据图回答:

(1)过程①构建A基因的重组DNA时,必须使用 、
两种工具酶和 。
(2)过程②采用的动物细胞工程技术是 ,获得的X是 。
(3)对该传染病疑似患者确诊时,可以从疑似患者体内分离病毒,用已知病毒的被
标记的DNA进行杂交,其原理是 ;或用图中的 与之进行特异性结合检测,其原
理是 。
33.(13分)下图是人们利用黄色短杆菌合成赖氨酸的途径。请回答下列问题:

(l)黄色短杆菌中含有遗传物质的结构分别是 和 。
(2)用黄色短杆菌生产赖氨酸,其培养基按化学成分划分属于 。
(3)由图可知,要增加赖氨酸产量,就必须培育不能合成高丝氨酸脱氢酶的菌种,具体方法是在 (固体、半固体、液体)培养基培养黄色短杆菌,再用适当剂量的紫外线照射,照射的目的是 ,最后用适当的方法筛选出所需菌种。
(4)若已得到二株变异菌株Ⅰ和Ⅱ,其赖氨酸的积累量较高。经测定菌株Ⅰ不能合成高丝氨酸脱氢酶,菌株Ⅱ高丝氨酸脱氢酶的活性较低。经进一步研究发现,突变发生在淀粉酶基因的编码区或非编码区,可推测出菌株Ⅰ的突变发生在 区,菌株Ⅱ的突变发生在 区。
(5)若图中代谢过程是黄色短杆菌合成甲硫氨酸、苏氨酸和赖氨酸的唯一途径,要培养上述菌株Ⅰ,培养基中至少必须添加 。
34.(6分)为探究影响光合作用强度的因素,将同一品种玉米苗置于25℃条件下培养,实验结果如图所示。请回答:

(1)图中纵坐标还可以用 的释放量或 的合成量表示。与D点相比,B点条件下限制玉米CO2吸收量的因素是 ,C点条件下限制玉米CO2吸收量的主要因素是 。
(2)实验结果表明,在含水量为 (回答区间)的条件下施肥效果明显。除本实验所涉及的因素外,从增加光合面积的角度考虑,采取
措施能提高玉米的光能利用率。
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入 (酸式,碱式)滴定管中。从此滴定管中放出20.00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品 (填字母编号)
B、0.5L 平底烧瓶 C、0.5L 容量瓶 D、0.5L圆底烧瓶 E、烧杯 F、试管 G、胶头滴管 H、量筒 I、托盘天平 J、药匙 M、滤纸 N、玻璃棒
(2)应称取 g 碳酸钠粉末来溶于水
有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。)
14.氢有三种同位素,分别是氕H、氘H、氚H,则下列说法正确的是
A.它们的质子数相等 B.它们的核外电子数相等
C.它们的核子数相等 D.它们的中子数相等
15.河宽420m,船在静水中速度为4m/s,水流速度是3m/s,则船过河的最短时间为
A.140 s B.105 s
C.84 s D. s
s
16.一定质量的气体,从状态Ⅰ经过不同过程变化到状态Ⅱ,已知状态Ⅱ的温度高于状态Ⅰ的温度。若气体分子之间的相互作用力在不发生碰撞时可以忽略不计,则在这些状态变化过程中
A.气体一定从外界吸收热量 B.气体和外界传递的热量一定相同
C.气体的内能变化量一定相同 D.外界对气体做的功一定相同
17. 如图在光滑地面上,水平外力F拉动小车和木块一起作无相对滑动的加速运动。小车质量是M,木块质量是m,力大小是F,加速度大小是a,木块和小车之间动摩擦因数是μ,则在这个过程中,木块受到的摩擦力大小是
如图在光滑地面上,水平外力F拉动小车和木块一起作无相对滑动的加速运动。小车质量是M,木块质量是m,力大小是F,加速度大小是a,木块和小车之间动摩擦因数是μ,则在这个过程中,木块受到的摩擦力大小是
A.μma B.ma
C. D.F-Ma
D.F-Ma
18.如图所示,Ⅰ、Ⅱ两条直线分别描述P、Q两个物体的s-t图象,下列说法正确的是
A.两物体均做匀速直线运动
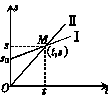 B.M点表示两物体在时间t内有相同的位移
B.M点表示两物体在时间t内有相同的位移
C.在时间t内P的位移较大
D.在时间t内P比Q的速度大,t时刻以后P比Q的速度小
19.用轻弹簧竖直悬挂质量为m的物体,静止时弹簧的伸长量为L现用该弹簧沿斜面方向拉住质量为2m的物体,系统静止时弹簧伸长量也为L斜面倾角为30°,如图所示.则物体所受摩擦力
A.等于零
 B.大小为mg,方向沿斜面向下
B.大小为mg,方向沿斜面向下
C.大于为mg,方向沿斜面向上
D.大小为mg,方向沿斜面向上
20. 频率不同的两束单色光1和2以相同的入射角从同一点射入一厚玻璃板后,其光路如右图所示,下列说法正确的是
频率不同的两束单色光1和2以相同的入射角从同一点射入一厚玻璃板后,其光路如右图所示,下列说法正确的是
A.单色光1的波长小于单色光2的波长
B.在玻璃中单色光1的传播速度大于单色光2 的传播速度
C.单色光1通过玻璃板所需的时间小于单色光2通过玻璃板所需的时间
D.单色光1从玻璃到空气的全反射临界角小于单色光2从玻璃到空气的全反射临界角
21.已知地球同步卫星离地面的高度约为地球半径的6倍。若某行星的平均密度为地球平均密度的一半,它的同步卫星距其表面的高度是其半径的2.5倍,则该行星的自转周期约为
A.6小时 B.12小时 C.24小时 D.36小时
第Ⅱ卷 (非选择题:共10题,共174分)
22.(6分)小球做直线运动时的频闪照片如图所示.已知频闪周期T=0.1s,小球相邻位置的间距(由照片中的刻度尺量得)分别为OA=6.51cm,AB=5.59cm,BC=4.70cm,CD=3.80cm,DE=2.89cm,EF=2.00cm。
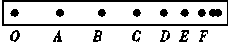
(1)小球在位置A时的速度大小vA= m/s。
(2)小球运动的加速度大小a= m/s2。
23.(12分)某同学在做平抛运动实验时得出如图所示的小球运动轨迹,a、b、c三点的位置在运动轨迹上已标出.则:(g取10 m/s2)
 (1)小球平抛的初速度为________m/s。
(1)小球平抛的初速度为________m/s。
(2)小球开始做平抛运动的位置坐标为________cm。
y=________cm。
(3)小球运动到b点的速度为________m/s。
24.(16)小球A用不可伸长的细绳悬于O点,在O点的正下方有一固定的钉子B,OB=d,初始时小球A与O同水平面无初速度释放,
 绳长为L,为使小球能绕B点做完整的圆周运动,
绳长为L,为使小球能绕B点做完整的圆周运动,
如图所示。试求d的取值范围。
25. (18分)2003年10月15日,我国宇航员杨利伟乘坐我国自行研制的“神舟”五号飞船在酒泉卫星发射中心成功升空,这标志着我国已成为世界上第三个载人飞船上天的国家。“神舟”五号飞船是由长征-2F运载火箭将其送入近地点为A、远地点为B的椭圆轨道上,实施变轨后,进入预定圆轨道,如图所示。已知近地点A距地面高度为h,飞船在预定圆轨道上飞行n圈所用时间为t,地球表面的重力加速度为g,地球半径为R,求:
(18分)2003年10月15日,我国宇航员杨利伟乘坐我国自行研制的“神舟”五号飞船在酒泉卫星发射中心成功升空,这标志着我国已成为世界上第三个载人飞船上天的国家。“神舟”五号飞船是由长征-2F运载火箭将其送入近地点为A、远地点为B的椭圆轨道上,实施变轨后,进入预定圆轨道,如图所示。已知近地点A距地面高度为h,飞船在预定圆轨道上飞行n圈所用时间为t,地球表面的重力加速度为g,地球半径为R,求:
(1)飞船在近地点A的加速度为多少?
(2)飞船在预定圆轨道上飞行的速度为多少?
26.(20分)如图10所示,质量为M的长木板,静止放置在粗糙水平地面上,有一个质量为m、可视为质点的物块,以某一水平初速度从左端冲上木板.从物块冲上木板到物块和木板达到共同速度的过程中,物块和木板的v-t图象分别如图中的折线acd和bcd所示,a、b、c、d点的坐标为a(0,10)、b(0,0)、c(4,4)、d(12,0).根据v-t图象,求:

(1)物块冲上木板做匀减速直线运动的加速度大小a1,木板开始做匀加速直线运动的加速度大小为a2,达相同速度后一起匀减速直线运动的加速度大小为a3;
(2)物块质量m与长木板质量M之比;
(3)物块相对长木板滑行的距离Δs.
27.(每小题3分,共15分)
(1)实验室制取氯气反应的离子方程式为
(2)工业上制取漂白粉反应的化学方程式为
(3)配平: KClO3+ H2C2O4+ H2SO4 → K2SO4+ ClO2↑+ CO2↑+ H2O
(4)二氧化碳气体通过一定量的过氧化钠固体,固体增重2.8g时,放出热量为Q KJ
则此反应的热化学方程式为
(5)标况下3.136 L Cl2通入0.1 L FeBr2溶液中,测得溶液Br-中消耗了三分之二,则此时总反应的离子方程式为
28.(每空2分,共14分)
13.用惰性电极电解含有0.1molNaCl与0.1molCuSO4的溶液0.5L,此过程中当转移了0.3mol电子时,阳极上析出的气体总共为
A.0.05 mol B.0.075mol
C.0.1 mol D.0.125 mol
12.1mol 与足量的NaOH溶液充分反应,最多能消耗
NaOH的物质的量为
A.2 mol B.3 mol
C.4 mol D.5 mol
11.在FeS2 + O2 → Fe2O3 + SO2 反应中,还原剂与还原产物的物质的量之比为
A.2:5 B.1:4
 C.2:1
D.1:2
C.2:1
D.1:2
10.下列叙述正确的是
A.同族元素的氢化物的沸点随相对分子质量的增加而递增
B.干冰晶体中的作用力只存在分子之间作用力
C.碱金属的单质的沸点随相对原子质量的增加而递降
D.向碳酸钠溶液中通入过量的二氧化碳,溶液会变浑浊
9.在溶液中能大量共存的离子组是
A.Ba2+、HSO4- 、Cl- 、NO3- B.Fe3+、NH4+ 、SCN- 、OH-
C.OH-、Ag(NH3)2+、Na+ 、K + D.HS- 、Na+、ClO-、Fe2+
8.设N表示阿伏加德罗常数的值,则下述不正确的是
A.1molC670H1342中含有的共价键数为2011N B.12g金刚石中的碳碳单键数为2N
C.48g O2与O3混合气体中含氧原子个数为3N D.78g过氧化钠晶体中离子总数为4N
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com