
12.答案:(1)2 5 === 3 2 1 1 (说明:错一个即不给分)
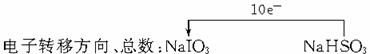
(2)开始阶段由于HSO 被氧化生成H+和SO
被氧化生成H+和SO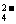 ,酸性加强,反应速度增大
,酸性加强,反应速度增大
解析:(1)考查氧化还原方程式的配平;(2)考查影响化学反应速率的外界条件。
由题意,速率加快的原因不可能是:①压强增大;②温度升高;③催化剂的使用;④反应物HSO 、IO
、IO 浓度增大。只能是由于5HSO
浓度增大。只能是由于5HSO +2IO
+2IO ===5SO
===5SO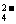 +I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
+I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
●命题趋向与应试策略
11.答案:(1)0.013 (2)1.0 催化剂 (3)> > (4)吸热 温度升高时,平衡向右移动
解析:(1)vA= =0.013 mol·(L·min)-1
=0.013 mol·(L·min)-1
(2)对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol·L-1,又因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min到20 min,实验1的A的浓度变化值为0.13 mol·L-1,而实验3的A的浓度变化值为0.17 mol·L-1,这就说明了v3>v1。又知从0 min到10 min A的浓度的变化值应大于0.17 mol·L-1,即c3>(0.92+0.17)mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验4 A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。
10.答案:(1)B C (2)D A
解析:此题以化学平衡知识为载体,考查了考生思维的有序性和严密性。解此题时首先要审清在题给条件下,只有S是固态,其余的物质都是气态。
容积固定的条件下,只有反应A在反应前后气体密度发生了变化。B反应后气体分子数减少,p前>p后;C反应前后气体分子数不变,即p前=p后。?
在压强不变,容积可变的条件下,反应A的产物只有水,密度必然减少,反应B的分子数减少,反应后密度必然增大,反应C的密度不发生改变,反应D的分子数增多,反应后密度必然减少。
9.答案:CD
解析:反应的平均速率是指单位时间内某物质浓度的变化量。已知容器体积为5 L,时间半分钟即30 s,NO的物质的量(变化量)为0.3 mol,则c(NO)=0.3 mol/5 L=0.06 mol·L-1。
所以 (NO)=0.06 mol·L-1/30 s=0.002
mol·L-1·s-1。即可求出:
(NO)=0.06 mol·L-1/30 s=0.002
mol·L-1·s-1。即可求出:
 (O2)=0.002 mol·L-1·s-1×
(O2)=0.002 mol·L-1·s-1×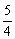 =0.0025 mol·L-1·s-1;
=0.0025 mol·L-1·s-1;
 (H2O)=0.002 mol·L-1·s-1×
(H2O)=0.002 mol·L-1·s-1×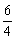 =0.003 mol·L-1·s-1;
=0.003 mol·L-1·s-1;
 (NH3)=0.002 mol·L-1·s-1×
(NH3)=0.002 mol·L-1·s-1× =0.002 mol·L-1·s-1。
=0.002 mol·L-1·s-1。
8.答案:A
7.答案:B
解析:在可逆反应中使用催化剂,能同等倍数改变正、逆化学反应速率,但不能改变反应的程度(指反应物的转化率或产率,或达到平衡时某物质在反应混合物中的含量),对照选项只有B项符合。
6.答案:A
解析:对于化学反应的速率,当温度升高时,反应速率增大,故选A。
5.答案:D
解析:本题属信息迁移题。意在考查学生接受新信息、处理所给数据的能力。按题给数据代入v=k[c(H2)]m[c(Cl2)]n即可。第一组数据无法计算,代入第二组数据:2.0k=k(2.0)m(1.0)n,则m=1;代入第三组数据:4.0k=k(2.0)m(4.0)n,结合m=1,则n= 。故选D。
。故选D。
4.答案:AD
解析:NH3平均每秒钟的浓度变化,即v(NH3)=0.001 mol·L-1·s-1。其余根据同一反应用不同物质表示的反应速率之比等于方程式化学计量数之比可得出。
3.答案:C
解析: (H2O)=
(H2O)= 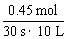 =0.0015
mol·L-1·s-1,则
=0.0015
mol·L-1·s-1,则
 (NO)=0.0010
mol·L-1·s-1,
(NO)=0.0010
mol·L-1·s-1,
 (NH3)=0.0010
mol·L-1·s-1,
(NH3)=0.0010
mol·L-1·s-1, (O2)=0.00125 mol·L-1·s-1
(O2)=0.00125 mol·L-1·s-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com