
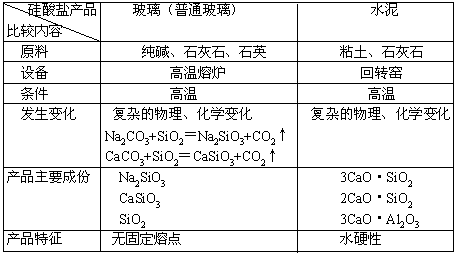
5. 常见硅酸盐产品比较
4. 硅及其化合物“反常”性质:
(1)硅的还原性比碳弱,但碳在高温下却能从SiO2中还原出硅:
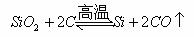
这是由于生成物CO气体逸出原因。
(2)非金属单质与强碱反应一般不生成氢气(请回忆Cl2)而硅却能:

(3)虽然 是硅酸的酸酐,但却不能用
是硅酸的酸酐,但却不能用 与水反应生成硅酸,而只能用硅酸盐跟较强酸(HCl、H2CO3)制得。
与水反应生成硅酸,而只能用硅酸盐跟较强酸(HCl、H2CO3)制得。
(4)酸性氧化物一般不与酸反应(除氧化还原反应外),而 却能与氢氟酸反应,但与其它常见酸不反应。(H2SO4、HNO3、HCl等)
却能与氢氟酸反应,但与其它常见酸不反应。(H2SO4、HNO3、HCl等)
 (氢氟酸可腐蚀玻璃)
(氢氟酸可腐蚀玻璃)
(5)非金属氧化物一般是分子晶体(如CO2、NO2、SO2等),而 却是原子晶体。
却是原子晶体。
(6)无机酸一般易溶于水,而硅酸和原硅酸(H4SiO4)却难溶于水。
(7)较强酸能把较弱酸从其盐溶液中制取出来,这是复分解反应的一般规律,因此H2CO3可制H2SiO3: ,但在高温下
,但在高温下 却能由较弱酸性氧化物制得较强酸性氧化物,其原因是,生成的CO2是气体,离开反应体系而使反应进行到底。
却能由较弱酸性氧化物制得较强酸性氧化物,其原因是,生成的CO2是气体,离开反应体系而使反应进行到底。
(8)硅酸钠的水溶液俗称水玻璃,但它和玻璃的成分不完全相同,硅酸钠也俗称泡花碱,但它是盐不是碱。
(9)钢化玻璃与普通玻璃成份相同,石英玻璃与普通玻璃成份却不同。
3. CO的有关知识:
(1)物理性质:
无色无味气体,密度接近空气,难溶于水,有剧毒。
(2)化学性质:
CO的化学性质主要是还原性,如:
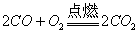 (可燃性)
(可燃性)
 (冶炼金属)
(冶炼金属)
2. CO2与SiO2
|
|
CO2 |
SiO2 |
|
电子式 |
 |
/ |
|
晶体类型 |
分子晶体 |
原子晶体 |
|
俗称 |
干冰(固态时) |
硅石、石英、水晶 |
|
化学性质 |
1. 酸性氧化物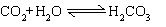   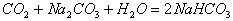 2. 弱氧化性: 2. 弱氧化性: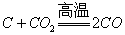  |
酸性氧化物 SiO2不能与水反应生成H2SiO3 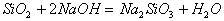  |
1. 碳(金刚石为例)、硅单质的比较
列表如下:
|
|
碳 |
硅 |
|
原子结构示意图 |
 |
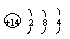 |
|
原子半径 |
相对较小 |
相对较大 |
|
单质晶体类型 |
原子晶体(金刚石) |
原子晶体 |
|
单质熔点 |
熔点很高 |
比金刚石稍低 |
|
化学性质 |
1. 还原性: (可燃性) (可燃性)   (制粗硅) (制粗硅) (制水煤气) (制水煤气)2. 氧化性  |
还原性: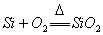  |
2. 硅单质、SiO2的重要性质
1. 碳单质、CO、CO2、碳酸盐的重要性质
5. 初步了解新型无机非金属材料,认识化学在社会、科技中的重要作用。
4. 初步了解硅酸盐工业及其产品,认识化学与生产、生活的联系。
3. 理解硅及其化合物的重要性质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com