
8. (福建省南安华侨中学2009届高三上学期期中考试卷)下列指定实验的装置图完全正确的是

A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
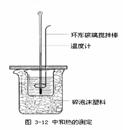

C.中和热的测定 D.分离苯和甲苯
[解析]A项中用托盘天平称量时应时左物右码,同时由于NaOH具有腐蚀性,称取时应将NaOH放在一小烧杯中,故A项错误;100mL的容量瓶只能配制100mL的溶液,不能配制150mL的溶液,故B项错误; C项正确;蒸馏时,冷凝管中的水流应为下进上出的逆流方式,故D项错误21世纪教育网
[答案]C
7.(福建省漳州市芗城中学2009届高三一轮复习单元测试)以已知浓度的NaOH溶液滴定未知浓度的盐酸,下列情况,测得结果偏低的是
①用酚酞作指示剂 ②滴定管用水洗后,未用标准溶液润洗就装入标准溶液 ③锥形瓶盛待测液前,未用待测液润洗④读数时,滴定前仰视,滴定后俯视 ⑤用于取待测液的移液管未用待测液润洗 ⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
A.①③④ B.②③⑥ C.②⑥ D.④⑤⑥
[解析]①用酚酞作指示剂无影响;②滴定管用水洗后,未用标准溶液润洗就装入标准溶液,这样标准液的浓度偏低,所用标准液的体积偏高,计算所得盐酸的浓度偏高;③锥形瓶盛待测液前,未用待测液润洗无影响;④读数时,滴定前仰视,滴定后俯视,所用标准液的体积偏小,计算所得盐酸的浓度偏低;⑤用于取待测液的移液管未用待测液润洗,使所取待测液浓度偏低,所用标准液的体积偏小,计算所得盐酸的浓度偏低;⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液,使待测液的物质的量偏少,所用标准液的体积偏小,计算所得盐酸的浓度偏低。故正确选项为D项21世纪教育网
[答案]D
6.(福建省漳州市芗城中学2009届高三一轮复习单元测试)实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是
A.1000mL,212g B.950mL,543.4g
C.任意规格,572g D.500mL,286g
[解析]实验室中没有950mL的容量瓶,故配制950mL 2mol/L的Na2CO3溶液时需用1000mL的容量瓶,通过计算所用Na2CO3的质量为212g,故A项正确。
[答案]A
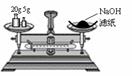
5. (天津市汉沽一中2008-2009学年度高三第四次月考)用右图所示装置进行如下实验,能达到实验目的的是
(天津市汉沽一中2008-2009学年度高三第四次月考)用右图所示装置进行如下实验,能达到实验目的的是
A.瓶中盛满水,从B口进气,用排水法收集NO2
B.瓶中盛适量浓硫酸,从A口进气来干燥NH3
C.从B口进气,用排空气法收集CO2
D.瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
[解析]A项中NO2不能用排水法收集;B项中NH3不能用浓硫酸干燥;C项中从B口进气,相当于向下排空气法收集气体,故不能用于收集CO2;D项正确。
[答案]D
4.(安徽省合肥八中2008-2009学年度高三第三次月考)下列操作或仪器的选和正确的是21世纪教育网
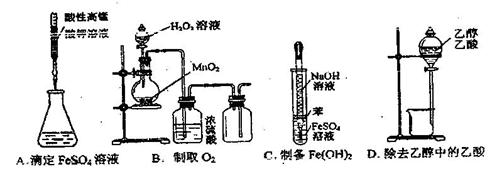
[解析]A项中酸性高锰酸钾显强氧化性,应盛放在酸性滴定管中;B项中氧气的密度大于空气的密度,收集氧气时应用向上排空气法,即集气瓶中应是长管进短管出;C项中由于Fe(OH)2易被氧化,故滴加NaOH溶液时,应将胶头滴管伸入到FeSO4溶液中滴加溶液;D项中乙醇与乙酸相互溶解,不能用分液漏斗分离21世纪教育网
[答案]C
3. (浙江义乌中学08-09学年高三上学期期中考试)下列操作中正确的是
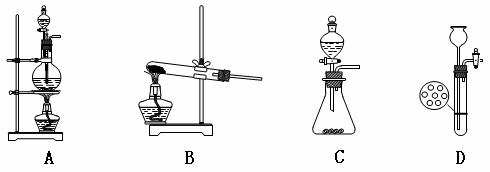
[解析]试管中液体体积加热时不超过1/3,故A项错误;HCl不易溶于CCl4,故B项正确;C项试剂瓶的瓶塞应倒放在桌面上,故C项错误;D项中应将试管横放,故D项 错误。
[答案]B
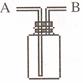
2.(浙江省宁波市鄞州高级中学08-09学年高三上学期期中考试)已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于氨气吸收的是
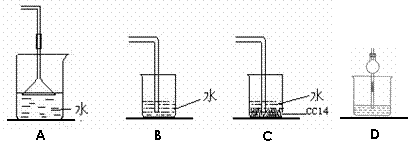
[解析]A项倒扣的漏斗使NH3充分吸收同时防止倒吸现象的发生;B项由于NH3易溶于水,可发生倒吸现象;C项由于NH3难溶于CCl4,NH3与CCl4接触不易发生倒吸现象;D项由于干燥管的上部大,防止倒吸现象的发生。故B项正确。
[答案]B
1.(海南三亚一中2009届高三年级第三次月考)下列操作中不是从安全角度考虑的是
A.做氢气还原氧化铜的实验时先通氢气以排净装置中的空气再加热
B.稀释浓硫酸时,将浓硫酸沿烧坏壁慢慢注入水中并不断搅拌
C.给试管中的液体加热时,试管口不能对着自己或他人
D.用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1-2min
[解析]A氢气还原氧化铜实验先再氢气通加热,则氢气不会与空气混合受热而易引起爆炸;B稀释浓硫酸时,将浓硫酸沿烧坏壁慢慢注入水中并不断搅拌,这样能使混合产生的大量热及时散发,不会引起液体飞溅;C给试管中的液体加热时,试管口不能对着自己或他人,这样防止伤人;D用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1-2min以除去废铁表面的油污,此操作不是从安全角度考虑的21世纪教育网
[答案]D
16.(2009广东卷19)某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
|
14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= .
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
[解析](1)检查装置气密性首先要关闭活塞K,并将末端导管插入试管A的水中形成密闭系统,而是要通过升温形成压强差。(2)由题给(4)的②可知,若N2中混有O2会使产物不纯,因此要隔绝氧气对反应的影响,末端导管必须插入试管A的水中可防止氧气进入。(3)此处要联想初中氧气制备作答,因为温度降低会导致压强减小,出现倒吸现象,所以要首先撤出导管,在熄灭酒精灯。(4)①由题给实验数据可知:
m(Ca )=m1-m0=15.08-14.80=0.28g
则n(Ca )=0.28g/40g·moL-1=0.007mol
m(CaxN2)=15.15-14.80=0.35g
则m(N)=0.35g-0.28g=0.07g
n(N)=0.07g/14g·mol-1=0.005mol 因为n(Ca ):n(N)=7:5,所以x=2×7/5=2.8
②因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
[答案](1)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质试管,若末端导管有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,在导管内形成一段水柱,并且一段时间不回落,则证明装置的气密性良好21世纪教育网 (2)反应过程中末端导管必须始终插入试管A的水中,目的是:防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质。 (3)反应结束后,先将末端导管从试管A中拔出,再熄灭酒精灯。 (4)x=2.8;因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
[考点分析]这是一条以定量试验为基础的综合性较强的实验题,主要涉及:气密性检查、实验安全、实验计算、误差分析、装置分析和评价21世纪教育网
[专题突破]
15.(2009江苏高考化学15)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
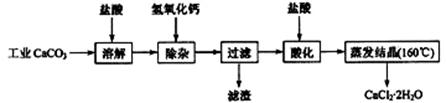
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中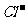 含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3
溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有:
。②计算上述样品中CaCl2·2H2O的质量分数为:
。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:
;
。
含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3
溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有:
。②计算上述样品中CaCl2·2H2O的质量分数为:
。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:
;
。
[解析](1)Fe(OH)3若没有沉淀完全,则会有Fe3+存在,检验Fe3+的存在用KSCN溶液最好,检验时一定要取上层清液,检验现象才能明显;
(2)空气中的CO2会影响产品的纯度,所以应该防止溶液吸收空气中的CO2。
(3)①滴定实验中,需润洗的仪器有滴定管、移液管,该实验是用 AgNO3 溶液滴定 待测液的,所以需要润洗的仪器一定有酸式滴定管。
② 根据关系式:CaCl2·2H2O ~ 2AgNO3
147 2
α×0.7500×25/250 0.05000×0.02039
解得:α=0.9991=99.9%
③根据反应:CaCl2·2H2O ~ 2Cl-~ 2AgNO3若Cl-偏多,则滴定的结果就会偏高,所以样品中若混有含氯量高于CaCl2的或CaCl2·2H2O 晶体中的结晶水失去一部分都能使CaCl2·2H2O的质量分数偏高;
[答案](1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全(2)防止溶液吸收空气中的CO2 (3)①酸式滴定管 ②99.9% ③样品中存在少量的NaCl ,少量CaCl2·2H2O 失水
[考点分析]本题以工业生产为载体,综合考查化学实验。考查物质的检验、常见仪器的使用注意点、误差分析、计算等方面,综合考查学生对实验原理的理解能力,对实验方案的评价分析能力21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com