
26.(9分)(1)蒸馏法
(2)蒸发结晶 ①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3) Mg(OH)2 MgCl2 通电 Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
(4) NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△ Na2CO3+ H2O+CO2↑ 氨气溶于水形成碱性溶液,更易于吸收二氧化碳
2009.烟台) 26.(9分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
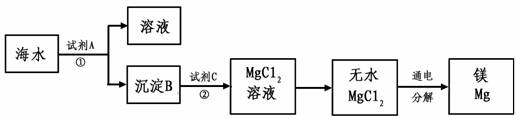 (3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。

步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降
低。这是因为 。
21.(5分)(1)单质 (2)食醋 (3)钾 (4)CaCO3 + 2HCl=CaCl2 + CO2↑+ H2O (5)CO
2009.烟台) 21.(5分)化学就在我们身边,与我们的生活息息相关。请回答以下生活中的问题:
(1)“沙里淘金”说明黄金在自然界中能够以 (填“单质”或“化合物”)
形式存在。
(2)葡萄表皮上因喷洒“波尔多液”而呈现的蓝色魔点,可以用厨房调料 洗净。
(3)刘大爷种的小麦出现倒伏现象,你会建议他使用化肥中的 肥。
(4)长期使用的暖水瓶内胆常有一层水垢(主要成分为碳酸钙),可以用稀盐酸除去。请写出反应的化学方程式: 。
(5)通常所说的煤气中毒是指由 (填物质化学式)引起的中毒。
2009.烟台) 20.向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是 B

18.(2009.烟台)要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
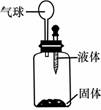 ①石灰石和稀盐酸 ②镁和稀硫酸
①石灰石和稀盐酸 ②镁和稀硫酸
③固体氢氧化钠和水 ④生石灰和水
(A)①②③④ (B)①②③
(C)①②④ (D)②③④
17.(2009.烟台)下列除去杂质的方法中,正确的是
|
选项 |
物质(括号内为杂质) |
去除杂质的方法 |
|
A |
NaCl溶液(Na2CO3) |
加入适量的CaCl2溶液、过滤 |
|
B |
CaO(CaCO3) |
加水、过滤 |
|
C |
Fe(Zn) |
加过量FeSO4溶液、过滤 |
|
D |
HNO3溶液(H2SO4) |
加适量BaCl2溶液、过滤 |
4、根据热化学方程式含义计算

 例4(09全国)已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
; CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
例4(09全国)已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
; CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
 。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )
。现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )

 A.1∶1
B.1∶3
A.1∶1
B.1∶3
 C.1∶4 D.2∶3
C.1∶4 D.2∶3
解析:根据热化学方程式含义知2mol氢气反应放热571.6KJ、1molCH4反应放热890KJ。设H2、CH4的物质的量分别为x、ymol。则x + y =5;571.6x/2 + 890y = 3695,解得x=1.25mol、y=3.75mol,两者比为1:3。



 答案:B
答案:B
技巧点拨:方程式组是解答化学计算的一种常用方法,因而计算时要寻找相关等量关系列式即可。
3、利用盖斯定律计算
例3、 (09山东,有改动)O2 (g)= O+2(g)+e-
(09山东,有改动)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1 ①
;PtF6(g)+ e-1
①
;PtF6(g)+ e-1  PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1 ②;O2+PtF6-(s)=O2+(g)+PtF6-
②;O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1 ③。则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的
③。则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
解析:考查盖斯定律的应用。由新反应方程式可知O2(g)来源于①、PtF6 (g)来源于②、O2+PtF6- (s)来源于③的反方向,故将化学方程式①+②-③叠加即得新化学方程式, H=
H= H1+
H1+ H2-
H2- H3=-77.6kJ·mol-1 。
H3=-77.6kJ·mol-1 。
答案:-77.6
技巧点拨:对于该类问题应先写出所求反应热的化学方程式,然后分析物质来源,进而利用盖斯定律加减即可
2、从物质能量变化角度考查
 例2.(08重庆卷)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
例2.(08重庆卷)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g); △H=(a+b)kJ·mol-1
H2(g)=NH3(g); △H=(a+b)kJ·mol-1
解析:由图可以看出,molN2(g)+molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,所以N2(g)+N2(g)===NH3(g);△H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有:N2(g)+N2(g)===NH3(l);△H=(a-b-c)kJ/mol,即:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1。
答案:A。
知识拓展:反应热的本质就是物质通过化学反应向外界吸收或释放能量的过程,只与反应物、生成物的总能量有关,与反应条件、反应过程无关。当反应物的总能量高于生成物的总能量时则反应放出能量,当反应物的总能量低于生成物的总能量时则反应吸收能量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com