
3.(2006山东文、理)在△ABC中,角A、B、C的对边分别为a、b、c,A=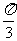 ,a=
,a=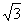 ,b=1,则c=( )
,b=1,则c=( )
(A)1 (B)2 (C)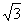 -1 (D)
-1 (D)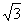
2.(2007重庆理)在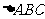 中,
中,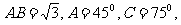 则BC =( )
则BC =( )
A. B.
B.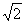 C.2 D.
C.2 D.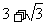
1.(2008北京文)已知△ABC中,a=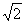 ,b=
,b=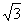 ,B=60°,那么角A等于( )
,B=60°,那么角A等于( )
(A)135° (B)90° (C)45° (D)30°
9、 A、B、C、D、E、F、G为七种由短周期元素构成的微粒。它们都有10个电子。其结构特点如下表:
|
微粒代号 |
A |
B |
C |
D |
E |
F |
G |
|
原子核数 |
单核 |
 单核 单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数 (单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中,B的离子半径大于E的离子半径;D是极性键构成的4原子极性分子;C常用作F的检出(加热)。请填写以下空白:
(1)A微粒的结构示意图是 。
(2)比较BC和EC2的碱性强弱BC EC2(填写>、<、=)。
(3)F与G 反应的离子方程式 。
8. 有X、Y、Z三种元素,已知①它们是周期表中前20号元素,X、Y和Z均不在同一周期;②它们可以组成化合物XY2,YZ2和XZ;③X的阳离子和Z的阴离子的核外电子排布相同;④Y很难形成简单的阳离子或阴离子。请填写下列空白:
⑴X ;Y ;Z (添元素符号)。
⑵XY2与水反应的化学方程式是 。
⑶在XY2,YZ2和XZ 中,含有非极性键的是 ,含有极性键的非极性分子是 (填化学式)。
7. 今有A、B、C、D四种短周期元素,它们的核电荷数依次增大.A和C,B和D分别是同主族元素,B、D两元素的质子数之和是A、C两元素的质子数之和的两倍.这四种元素中有一种元素的单质易溶解于CS2溶剂中。则四种元素是A 、B 、C 、 D 。A和D两元素可由 键形成 化合物,该化合物的电子式为 写出两种均含四种元素的化合物相互反应的化学方程式: 。
6. 有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、2、7、6、4,原 子序 数按E、B、C、A、D的顺序依次增大.D的最高价氧化物的式量与气态氢化物的式量之比为1. 57∶1,且该原子核内有45个中子,A、B、C原子的次外层都有8个电子,E原子的次外层有2 个电子.
(1)计算D的原子量 ;
(2)画出D的原子结构示意图 ;
(3)写出元素符号:A 、B 、C 、D 、E ;
(4)按酸性由强到弱、碱性由弱到强的顺序写出它们最高价氧化物对应水化物的化学式 ;
5. 下表标出的是元素周期表的一部分元素,回答下列问题:


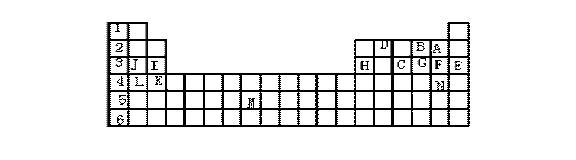
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 。
4. 短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A. 原子半径A<B<C B .A的氢化物的稳定性大于C的氢化物
C. B的氢化物的熔点比A氧化物高 D. A与C可形成离子化合物
3. A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A .A、B、C、D、E B. E、C、D、B、A
C. B、A、D、C、E D. C、D、A、B、E
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com