
2.由主要化合价可知AB为IIA族,CE为VIA族,D为IIIA族;由原子半径知BE为第2周期元素,ACD为第3周期元素。根据同周期及同主族元素原子半径的递变规则,C元素的原子半径应该介于D元素和E元素之间。
19.⑴ 随着 原子序数增大,E值变小 周期性 ⑵ ①③
⑶ 439 738 (填E(钾)、E(镁)也给分)
⑷ 10号元素是氖。该元素原子的最外层电子排布已达到8电子稳定结构。(注:达到8电子稳定结构也给分)
|
⑶ Al S H2SO4 Al(OH)3
⑷ 周期性变化 元素的周期数即为原子核外电子层数,
元素的主族序数即为元素原子的最外层电子数。
[解题指导]
18.⑴ 否 若三者处于同一周期,则最外层电子数之和不可能为17; ⑵ N O S ; ⑶ 硫酸铵 (NH4)2SO4 。
17.⑴ N;Si;S;Ca ⑵ K;F;Ar
⑶ HClO4;KOH;Al(OH)3 ; 3HClO4 + Al(OH)3 = Al(ClO4)3 + 3H2O
HClO4 + KOH = KClO4 + H2O ; KOH + Al(OH)3 = KAlO2 + 2H2O ⑷.K;F
⑸.方案一:用Mg条和Al片分别和同浓度的盐酸反应反应,观察其反应速率的快慢。
方案二:分别向AlCl3溶液、MgCl2溶液中加入NaOH溶液,观察其沉淀及其溶解情况。
(或其他合理答案)
⑹.氯 H2S + Cl2 = 2HCl + S↓
16.⑴ Li2O Li3N
⑵ Be(OH)2 Be(OH)2 + 2OH- = BeO2- 2 + 2H2O Be(OH)2 + 2H+ = Be2+ + 2H2O
⑶ Al4C3 + 4OH- + 4H2O = 4AlO- 2 + 3CH4↑
⑷ 加热至熔融状态,测量其导电性。
6、BC 7、D 8、D 9、B 10、CD 11、AC 12、B 13、D 14、AD 15、BC
1、B 2、B 3、A 4、D 5、B
20.(A)
 ⑴.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
⑴.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
⑵.元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。
⑶.元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________。
甲、乙的最高价氧化物水化物的酸性强弱为:________>________(用化学式表示)。
⑷.元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:____________________________________________________。
19.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
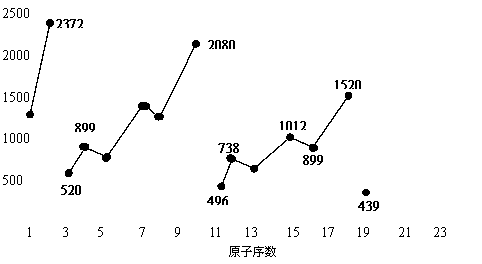
⑴.同主族内不同元素的E值变化的特点是:__________________________。各主族中E值的这种变化特点体现了元素性质的__________变化规律。
⑵.同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常。现试预测下列关系式中正确的是______(填写编号,多选倒扣)
① E(砷)>E(硒) ② E(砷)<E(硒)
③ E(溴)>E(硒) ④ E(溴)<E(硒)
⑶.估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:________< E <__________。
⑷.10号元素E值较大的原因是___________________。
18. X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:① 元素周期表中,Z与Y相邻,Z与W也相邻; ② Y、Z和W三种元素的原子最外层电子数之和为17。 请填空:
⑴.Y、Z和W三种元素是否位于同一周期(填“是”或“否”) ,理由是
。
⑵.Y是 、Z是 、W是 (填元素符号)。
⑶.X、Y、Z和W可组成一种化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com