
3. (安徽师大附中2009届高三上学期期中考试)有一瓶无色溶液,可能含有K+、Al3+、Mg2+、 、
、 、
、 、
、 、
、 离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
A.肯定有Al3+、Mg2+、 、
、 B.肯定有Al3+、Mg2+、
B.肯定有Al3+、Mg2+、
C.肯定有K+、 、
、 D.肯定有Al3+、Mg2+、
D.肯定有Al3+、Mg2+、
[解析]由①再加入足量的NaOH溶液后白色沉淀部分溶解知,溶液中一定含有Al3+、Mg2+,再有②知,溶液中一定含有 。
。
[答案]D
2. (安徽泗县一中2008-2009学年第一学期高三第二次考试)有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做。试推断其中F是
A.NaHCO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.Na2CO3溶液
[解析]通过两两混合实验,可观察的现象及结合表所示得到:只产生一种沉淀的是B为NH3·H2O,产生两种沉淀和一种气体的是A为Na2CO3,产生三种沉淀的是D为MgSO4,与A产生气体的是E为HNO3,与A和D产生两种沉淀的是C为BaCl2,没有明显现象的是F为NaHCO3。
[答案]A
1. (安徽泗县一中2008-2009学年第一学期高三第二次考试)下列根据实验现象所作出的结论中一定正确的是
A.无色试液中滴加酚酞试液,溶液变红,结论:该试液一定呈现碱性
B.某溶液加入盐酸,放出不能使品红溶液退色的气体,结论:试液中含有
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+、没有K+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中溶质为钙盐或钡盐
[解析]A项中溶液滴加酚酞试液变红,则依据指示剂的现象知:该试液一定呈现碱性;B项溶液中可能含有 干扰;C项钾元素的焰色为紫色,但必需通过蓝色的钴玻璃滤去黄光,从而说明不通过蓝色的钴玻璃,则会观察的是黄光,故无色试液焰色反应呈黄色,则试液中一定含有Na+、不能确定是否含有K+;D项中能与碳酸钠溶液产生白色沉淀,不仅是钙盐或钡盐,还有铝盐等。
干扰;C项钾元素的焰色为紫色,但必需通过蓝色的钴玻璃滤去黄光,从而说明不通过蓝色的钴玻璃,则会观察的是黄光,故无色试液焰色反应呈黄色,则试液中一定含有Na+、不能确定是否含有K+;D项中能与碳酸钠溶液产生白色沉淀,不仅是钙盐或钡盐,还有铝盐等。
[答案]A
17. (2009天津卷9)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图。

请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
[解析]本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
2NaOH + H2↑+ Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
[答案](1)蒸馏法 电渗析法 离子交换法 (或其他合理答案中的任意两种)
(2)Cl2 NaOH NaClO (3)富集溴元素
(4)Br2+SO2+2H2O 4H++ +2
+2 强酸对设备的严重腐蚀
强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分
④深红棕色 分液(或蒸馏)
[考点分析]本题注重理论和生产生活的实际结合,起点高,但题目平易近人。
[专题突破]
16.(2009山东卷30)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, ,过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。

(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
[解析](1)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2;检验Fe3+ 选择
(2)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流。
(3)CaCl2溶液不能与CO2反应,加入碱能反应,但又不能引入杂质,应通入NH3(或先加入NH3·H2O);氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,c装置中的倒置漏斗、d中的多空球泡可以防倒吸。
(4)注视凹液面的最低处与刻度线 凹液面的最低处与刻度线相平 酸式
[答案](1)c d
(2)冷却结晶 引流
(3)NH3 (或NH3·H2O) b d
[考点分析]以物质制备为背景,考查离子的检验、基本实验操作、实验安全、溶液配制。
15.(2009广东卷21)三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可有于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2 、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水,氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C)观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1 |
|
|
步骤2 |
|
|
步骤3 |
|
|
…… |
|
[解析](1)由A中澄清石灰水都变浑浊,可知K3 [Fe(C2O4 )3]·3H2O分解的产物中有CO2;由B中有红色固体生成,C中澄清石灰水变浑浊,可知K3 [Fe(C2O4 )3]·3H2O分解的产物中有CO。(2)因为所有的钾盐、钠盐和铵盐都可溶,所以验证钠、钾元素一般是用颜色反应。(3)由于草酸根中C为+3价,而产物中二氧化碳、碳酸钾中碳为+4价,一氧化碳中碳为+2价,存在着化合价的变化。由题意铁元素不可能以三价形式存在,说明铁的化合价一定发生变化,由铁的常见化合价不难得出,其一定会降低,可能为0价或+2价。由此不难得出三种假设。设计实验步骤时要注意铁和氧化亚铁均与盐酸反应生成亚铁离子,均与硝酸反应生成铁离子,也就是说铁的存在会干扰氧化亚铁的检验,所以要利用两者性质的差异性先检验出铁,排出铁的干扰。因此一定要用到硫酸铜溶液。由于题给试剂没有能够检验亚铁离子的试剂,所以要将其氧化为铁离子再检验,所以必须用到硝酸和硫氰化钾溶液。
[答案](1)则气体产物是:CO2和CO。 (2)验证固体产物中钾元素存在的方法是焰色反应,现象是透过蓝钴玻璃观察呈紫色火焰。(3)假设1:铁元素的存在形式为Fe单质;假设2:铁元素的存在形式为FeO;假设3:铁元素的存在形式为Fe与FeO的混合物。
|
实验步骤 |
预期现象与结论 |
|
步骤一:用药匙取少量固体产物于一支洁净干燥的试管A中,用胶头滴管滴加过量的煮沸过的0.1mol/LCuSO4溶液于试管中,振荡,静置,过滤,取出固体另一试管B中备用。 |
若出现大量红色固体,则证明假设1或假设3成立。
若不出现红色固体,则假设2可能成立。 |
|
步骤二:往试管B的固体加过量1mol/L盐酸,滴加少量20%KSCN溶液,再滴加少量煮沸过的1mol/LHNO3溶液。 |
加盐酸后,固体部分溶解。
若加入少量1mol/LHNO3后溶液变血红色,则证明原固体为Fe与FeO混合,假设3成立。
若加入少量1mol/LHNO3后溶液不变血红色,则证明原固体只含Fe,假设1成立 |
|
步骤三:若步骤一不出现红色固体。用药匙另取少量固体产物于一支洁净干燥的试管中,用胶头滴管滴加过量煮沸过的1mol/L的盐酸,滴加少量20%KSCN溶液,再滴加少量煮沸过的1mol/LHNO3溶液。 |
加盐酸后,固体全部溶解。若滴加KSCN溶液后,溶液不呈血红色,滴加1mol/LHNO3后溶液变血红色,则证明假设2成立。 |
[考点分析]以实验探究的形式考查学生的基本实验知识,突出考查实验方案的设计。
14.(2009宁夏卷26)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)

③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
[解析](1)本题的碱式碳酸铜与氢气反应看似一个很难的信息,其实细心一点只要把它理解为CuCO3和Cu(OH)2受热分解后产物CuO再与氢气反应,第①问题便可以解决;对于②要能分析出测定反应后CO2和H2O质量,因此对于氢气发生器后仪器的选择是除氯化氢和水蒸气,防止对后续测定影响就可以了,因为测定H2O和CO2分别用浓硫酸和碱石灰是固定的。(2)其实在分析(1)①方程式书写时便得到了碱式碳酸铜热分解方程式: xCuCO3·yCu(OH)
2·zH2O (x+y)CuO+ xCO2↑+(y+z)H2O↑,稍加分析可知,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
(x+y)CuO+ xCO2↑+(y+z)H2O↑,稍加分析可知,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
[答案](1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H
2  (x+y)Cu+ xCO2+(x+2y+z)H2O
(x+y)Cu+ xCO2+(x+2y+z)H2O
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
③1.8 CuCO3·Cu(OH) 2·H2O
(2)可行 根据反应xCuCO3·yCu(OH) 2·zH2O (x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
(x+y)CuO+
xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
[考点分析]本题以物质化学式的测定考查仪器组装。
13.(2009全国2卷29). (15分)现有A、B、C、D、E、F六种化合物,已知它们的阳离子有 ,阴离子有
,阴离子有 ,现将它们分别配成
,现将它们分别配成 的溶液,进行如下实验:
的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③
向D溶液中滴加 溶液,无明显现象;
溶液,无明显现象;
④ 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是 ;
(2)E溶液是 ,判断依据是 ;
(3)写出下列四种化合物的化学式:A 、C 、D 、F .
[解析]本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定 只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无
只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无 ,则F中的阴离子为
,则F中的阴离子为 ,D中的阴离子为
,D中的阴离子为 。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO-若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
[答案]

[考点分析]本题以离子共存的形式考查物质的鉴别。
12.(2008年山东理综30)食盐是日常生活的必需品,也是重要的化工原料。
(1) 粗食盐常含有少量 K+ 、Ca2+ 、 Mg2+ 、 Fe3+ 、 SO42― 等杂质离子,实验室提纯NaCl 的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2 溶液 75%乙醇 四氯化碳
 ① 欲除去溶液 I 中的Ca2+ 、Mg2+ 、Fe3+ 、SO42― 离子,选出 a 所代 表的试剂,按滴加顺序依次为 (只填化学式)。
① 欲除去溶液 I 中的Ca2+ 、Mg2+ 、Fe3+ 、SO42― 离子,选出 a 所代 表的试剂,按滴加顺序依次为 (只填化学式)。
② 洗涤除去NaCl晶体表面附带的少量KCl ,选用的试剂为 。
(2)用提纯的NaCl配制 500 mL 4 . 00 mol ·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
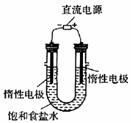
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“ > ”、“ = ”或“ < ”) ZL , 原因是_ 。装置改进后,可用于制备 NaOH 溶液,若测定溶液中 NaOH 的浓度,常用的方法为_ 。
(4)实验室制备H2 和 Cl2 通常采用下列反应:
Zn + H2SO4 = ZnSO4
+ H2 ↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2 的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:21世纪教育网

[解析](1)①要除去 ,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子
,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子 ,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的
,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的 。Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中。(3)2NaCl+2H2O
。Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中。(3)2NaCl+2H2O  2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。(4)由于制取氢气时不用加热,且氢气的密度小于空气,收集用向下排空气法,故用装置e制取氢气;制取氯气需用加热,且氯气的密度大于空气,收集用向上排空气法,又由于氯气有毒,需用尾气处理装置,故用装置d制取氯气。
2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。(4)由于制取氢气时不用加热,且氢气的密度小于空气,收集用向下排空气法,故用装置e制取氢气;制取氯气需用加热,且氯气的密度大于空气,收集用向上排空气法,又由于氯气有毒,需用尾气处理装置,故用装置d制取氯气。
[答案](1)①BaCl2 、NaOH 、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答 NaOH 不影响得分);②75 %乙醇; (2)天平、烧杯、 500mL 容量瓶、胶头滴管;(3)<;电解生成的氯气与电解生成的 NaOH 发生了反应;酸碱中和滴定;(4) e;d。
[考点分析]本题综合考查了物质的提纯、溶液的配制以及物质的制备。
11.(09海南卷1)将等体积的苯、汽油和水在试管中充分混合后静置。下列图示现象正确的是
( )

[答案]A
[考点分析]本题主要考查物质的溶解性和密度差异。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com