
7.(08年广东化学·6)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是A
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
答案:A
解析:m(Al):m(NaOH)=27:40;
m(Al(OH)3):m(NaOH)=75:40;
m(AlCl3):m(NaOH)=33.375:40;
m(Al2O3):m(NaOH)=51:40;
所以相同质量的物质,消耗碱量最多的是Al。故选A。
6.(2007海南·12)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考点:本题考查了物质的量的相关计算。
解析:本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
5.(2007海南·4)下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
答案:B
考点:本题考查了阿伏加德罗定律及其应用。
解析:由PV=nRT可知:气体的体积在温度、压强一定时,体积与物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小。 所以A、D错;B正确;只有标况下气体摩尔体积才近似为22.4L/mol。
4.(07年广东理基·22)已知阿伏加德罗常数为NA,下列说法正确的是
A.2 mol重水含有NA个D2O分子
B.1 g氢气含有NA个H2分子
C.2 mol钠与过量稀盐酸反应生成NA个H2分子
D.22.4 L水含有NA个H2O分子
答案:C
解析:2 mol重水含有2NA个D2O分子,故A选项错误;1 g氢气的物质的量为mol,因此含有有NA个H2分子,B选项错误;2 mol钠在反应中失去2mol电子,因此在反应中得到1mol,故C选项正确;水为液态,22.4 L水也不是1mol,故D选项错误。
3.(07年广东化学·3)下列叙述正确的是
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6gNO2气体含有1.81×1023个NO2分子
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×1023个H2O分子
答案:A
解析:解题时要注意回忆概念、分析原理注意运算公式的适用范围。B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2
 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
2.(07年宁夏理综·12) a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
答案:B
解析:根据题意可以知道,铁粉完全反应且反应前后固体的质量不变,因此设参加反应的CuSO4与H2SO4的物质的量分别为x和y,则:
Fe + CuSO4 = FeSO4+Cu △m
1mol 56g
x 56 x g·mol-1
Fe + H2SO4 = FeSO4+H2↑ △m
1mol 8g
y 8 y g·mol-1
因反应前后固体的质量没有发生变化,因此第一个反应质量的减小等于第二个反应质量的增加,即56x
g·mol-1=8 y
g·mol-1,所以 。
。
1.(07年宁夏理综·10)若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7︰4
答案:C
解析:Cl2作为氧化剂时化合价有0价降低为-1价,而Cl2是双原子分子,因此1 mol Cl2作为氧化剂得到的电子数应为2NA,故A选项错误;在标准状况(0℃、101kPa)时,22.4L氢气的物质的量的1mol,其中含有的H原子的物质的量为2mol,即含有2NA个氢原子,故B选项错误;14g氮气中含有的电子的物质的量为 =7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
=7mol,即电子数为7NA个,所以C选项正确;NA个一氧化碳分子的物质的量为1mol,其质量为28g,0.5 mol 甲烷的质量为0.5
mol × 16 g·mol-1=8g,所以而的质量比为28g︰8g=7︰2,因此D选项错误。
28.(16分)菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结
石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究。
[查阅资料]①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
[提出猜想]“菠菜豆腐不能同食”的原因可能是 ▲ 。
 [探究一]菠菜中部分成分分析
[探究一]菠菜中部分成分分析
(1)步骤③中加入足量的CaCl2溶液的目的 ▲ 。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAC表示,写出步骤④的化学反
应方程式 ▲ 。沉淀A、B的质量关系为:m(A) ▲ m(B)(填“>”、“<”
或“=”)。
(3)白色沉淀B的化学式为 ▲ ,由此可见菠菜豆腐不能同食。以下饮食观点正确的是
▲ (填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
[探究二]某草酸钙晶体(CaC2O4·xH2O)热分解研究
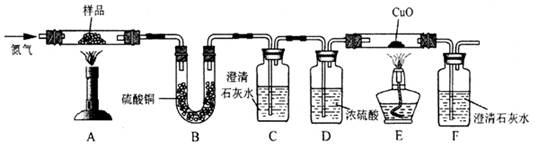 按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
(4)①反应开始前通入氮气的目的是 ▲ 。
②装置B中硫酸铜粉末变蓝,说明产物中有 ▲ ,C、F中澄清石灰水均变浑浊,E
中CuO变红,说明产物还有 ▲ 和 ▲ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议 ▲ 。
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得
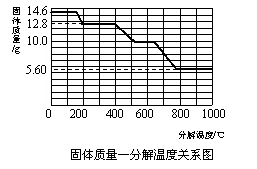 相关数据,绘制成固体质量-分解温度的关系如右图。
相关数据,绘制成固体质量-分解温度的关系如右图。
①800℃以上时,固体成分的化学式为 ▲ 。
②计算CaC2O4·xH2O中的x(写出计算过程,
CaC2O4的相对分子质量:128)。
③残留固体为CaC2O4时的温度范围 ▲ ,
写出固体质量由12.8g变为10.0g时的化学
方程式 ▲ 。
27. (8分)某研究性学习小组对双氧水开展如下研究。
(8分)某研究性学习小组对双氧水开展如下研究。
(1)图1中仪器①的名称 ▲ ,该装置中发
生的化学方程式为 ▲ 。图1装置也可
以用于实验室制 ▲ 气体(只填一种即
可)
(2)小杨同学将MnO2与水泥按一定比例加水
混合、凝固,制作成小块状固体,加入图
2装置中制氧气,以方便实验结束回收二氧化锰。实验前检查该装置气密性的方法是:
打开旋塞,从长颈漏斗口注水至 ▲ ,关闭旋塞,继续注水,使漏斗中液面略高于试
管中液面,一段时间后,高度差不变,说明气密性良好。其中块状固体应放置在 ▲ 处
(填“A”或“B”)
(3)利用图2装置反应一段时间后,需停止反应,其操作是 ▲ 。
(4)Cu与稀硫酸不能直接反应,但滴加H2O2溶液并加热,能生成水和一种蓝色溶液。则
该反应的化学方程式为 ▲ 。
26.(8分)下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。
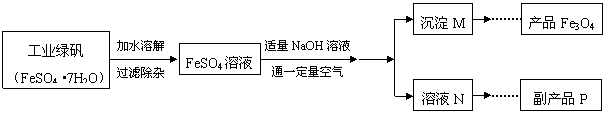
(1)铁的另两种常见氧化物的化学式是 ▲ 、 ▲ 。
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和 ▲ ,操作A的名称
是 ▲ 。
(3 )副产品P是 ▲ ,由溶液N获得该副产品的操作顺序是b→ ▲ → ▲ →d。
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
|
Fe3O4的过程中发生的反应为Fe(OH)2 + 2Fe(OH)3 === Fe3O4 + 4H2O,控制“一
定量空气 ”的目的是 ▲ ,沉淀M中Fe(OH)2 和Fe(OH)3的最佳质量比为 ▲ 。
(相对分子质量:Fe(OH)2 -90,Fe(OH)3-107)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com