
5.(09江苏卷 11) 下列离子方程式与所述事实相符且正确的是
11) 下列离子方程式与所述事实相符且正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效:
 B.用浓盐酸与
B.用浓盐酸与 反应制取少量氯气:
反应制取少量氯气:
 C.向
C.向 溶液中通入过量
溶液中通入过量 制
制 :
:


 D.在强碱溶液中次氯酸钠与
D.在强碱溶液中次氯酸钠与 反应生成
反应生成 :
:



 答案:C
答案:C
 解析:
解析:
漂白粉失效的化学方程式为 ,那么该反应的离子方程式是
,那么该反应的离子方程式是 ,A项错;
,A项错;
实验室制取 的原理是浓盐酸和二氧化锰反应,离子方程式为
的原理是浓盐酸和二氧化锰反应,离子方程式为

 ,所以B项错;
,所以B项错;
D项,在强碱溶液中,不可能生成 ,所以D错。
,所以D错。
4.(09江苏卷 7)在下列各溶液中,离子一定能大量共存的是
7)在下列各溶液中,离子一定能大量共存的是
 A.强碱性溶液中:
A.强碱性溶液中: 、
、 、
、 、
、
 B. 含有0.1 mol·L-1
B. 含有0.1 mol·L-1
 的溶液中:
的溶液中: 、
、 、
、 、
、
 C. 含有0.1 mol·L-1
C. 含有0.1 mol·L-1 溶液在中:
溶液在中: 、
、 、
、 、
、
 D. 室温下,pH=1的溶液中:
D. 室温下,pH=1的溶液中: 、
、 、
、 、
、

 答案:D
答案:D
 解析:
解析:
A项,强碱性溶液意味着存在大量的 ,所以
,所以 不能共存
不能共存
( );
);
B项, 和
和 因发生氧化还原反应而不能共存(
因发生氧化还原反应而不能共存( );
);
C项, 和
和 因发生复分解反应而不能共存
因发生复分解反应而不能共存
3.(09天津卷 4)下列叙述正确的是
4)下列叙述正确的是
 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
C.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
 D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降

 答案:D
答案:D
 解析:
解析:
A项,苯酚钠为碱性溶液,故错;
B项,温度不变,则Kw是不变的,错;
C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。
D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。
2.(09全国卷Ⅰ6)下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+ 、 、
、 、
、 B.
B.  、
、 、
、 、
、
C. 、Ba2+、
、Ba2+、 、
、 D.
D.  、
、 、
、 、
、

 答案:D
答案:D
 解析:
解析:
A项,加入NaOH会与NH4+ 产生NH3,但没有沉淀;
B项HCO3- 与AlO2- 不能共存,会生成Al(OH)3 沉淀。
C项,OH-与HSO3- 生成SO32 -,与Ba2+可生成BaSO3沉淀,但无气体。
D项,OH-与NH4+ 产生NH3,与Mg2+会产生Mg(OH)2沉淀,正确。
1.(09安徽卷10) 在溶液中能大量共存的一组离子或分子是
在溶液中能大量共存的一组离子或分子是
 A.
A. 、
、 、
、 、
、
 B.K+ 、Al+、
B.K+ 、Al+、 、NH3·H2O
、NH3·H2O
 C.Na+、K+、
C.Na+、K+、 、Cl2
、Cl2
 D.Na+ 、CH3COO-、
D.Na+ 、CH3COO-、 、OH-
、OH-

 答案:D
答案:D
 解析:
解析:
A项中H+与HCO3-能够反应生成CO2气体,不能大量共存,错误;
Al3+与氨水可以发生反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,B选项错误;
Cl2具有氧化性,可以将SO32-氧化为SO42-,方程式为:Cl2+H2O+SO32-=SO42-+Cl-+2H+,C选项错误。
29.(09宁夏卷 38)[化学-选修物质结构与性质](15分)
38)[化学-选修物质结构与性质](15分)
 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
 (1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
 (3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
 (4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
 (5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
 答案:
答案:
(1)1s22s22p63s23p63d104s24p3 As(2) (3)三角锥
(3)三角锥
 (4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O (5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O (5)稳定性:NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。

 解析:
解析:
(1)X元素原子的4p轨道上有3个未成对电子,可通过写电子排布式得到X为33号元素As;
(2) Y元素原子的最外层2p轨道上有2个未成对电子,同样根据电子排布式得到Y为O;再根据X、Y和Z三种元素的原子序数之和等于42可得到Z为H.
(3)-(5)就不再分析了。
28.(09海南卷 19)(20分)
19)(20分)
 19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
 19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
 A.Li,F B.Na,F C.Na,C1 D.Mg,O
A.Li,F B.Na,F C.Na,C1 D.Mg,O
 19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
 19-3.下列说法中错误的是:
19-3.下列说法中错误的是:
 A.SO2、SO3都是极性分子
A.SO2、SO3都是极性分子
 B.在NH4+
和[Cu(NH3)4]2+中都存在配位键
B.在NH4+
和[Cu(NH3)4]2+中都存在配位键
 C.元素电负性越大的原子,吸引电子的能力越强
C.元素电负性越大的原子,吸引电子的能力越强
 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性


 19-4(11分)
19-4(11分)
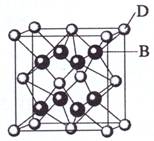
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
 请回答:
请回答:
 (1)A元素的名称是
;
(1)A元素的名称是
;
 (2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C
与A形成的化合物沸点高,其原因是
(2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C
与A形成的化合物沸点高,其原因是
 (3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
(3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
 (4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合
物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合
物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
答案:
19-1
 B (3分)
B (3分)
19-2
 B(3分)
B(3分)
19-3
 A(3分)
A(3分)
19-4
 (11分)
(11分)
(1)
 氢 (1分)
氢 (1分)
(2)
 F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
(3)
 四 VIIB 锰
四 VIIB 锰  (4分)
(4分)
(4)


 (3分)
(3分)
27.(09重庆卷29)(15分)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1) X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。
(2) X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3) 一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈
②A的化学式是
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是
答案:

解析:
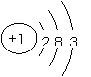 (1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为
(2)铝盐与过量NaOH溶液反应转化为偏铝酸盐,发生的离子反应方程式为:
Al3++4OH-===AlO2-+2H2O。
(3)①A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子个电子,可以推测Z是一种氢化物,常见的氢化物由NH3、CH4、HF等;Z与H2O2反应,其产物之一是Y的单质,知道Z是NH3。②A具有良好的耐热冲击性能,由以上几种元素与Al构成的化合物来看只有N与Al构成AlN。(4)由题意可以得到答案。
(2)水分子之间存在氢键且比硒化氢的分子间作用力强 (2分)
(3) (3分)
(3分)
(4) (3分)
(3分)
(5)2 (3分)
26.(09上海卷 23)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
23)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
 (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
 ①
① ②
② ③
③ ……
……
 反应②中形成的化合物的电子式为
;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为
;反应③中被破坏的化学键属
 于
键(填“极性”或“非极性”)。
于
键(填“极性”或“非极性”)。
 (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
 (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
 a.卤化银的颜色按AgCl、AgBr、AgI
的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI
的顺序依次加深
 b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
 d.卤素单质与氢气化合按
d.卤素单质与氢气化合按 、
、 、
、 、
、 的顺序由难变易
的顺序由难变易

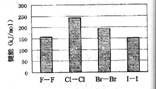 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
 ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键
 断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
 ②卤素单质键能大小与键长的关系为:
②卤素单质键能大小与键长的关系为:

答案:
 (1)
(1)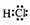 非极性
非极性
 (2)S Cl F 三 IA
(2)S Cl F 三 IA
 (3)a
(3)a
 (4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
(4)①不一定容易 ②除F2外,键长增长,键能减小 (合理即给分)
14.(09宁夏卷 37)[化学-选修化学与技术](15分)
37)[化学-选修化学与技术](15分)
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①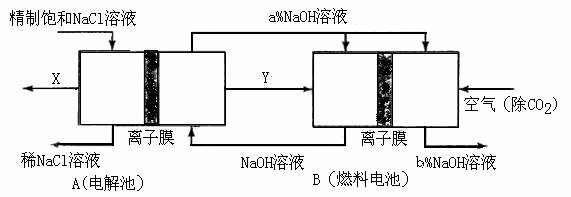 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
 答案:
答案:
(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89
(2)③①②
(3)①Cl2 H2 a%小于b% ②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O ③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)

 解析:
解析:
 (1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2
M(NaOH)=71/80=1:1.13或0.89;
(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2
M(NaOH)=71/80=1:1.13或0.89;
(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2 ;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH- 可知NaOH+浓度增大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com