
2.能量最低原理
现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
1.构造原理
⑴构造原理:随着核电荷数递增,大多数元素的电中性基 态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
⑵能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
⑶说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
5.核外电子运动状态的具体化描述
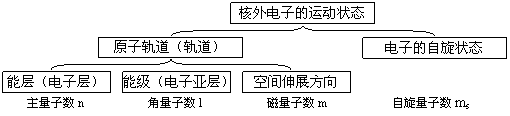
⑴核外电子的运动状态,由能层、能级、电子云的空间伸展方向、电子的自旋状态四个方面来描 述,换言之,用原子轨道(或轨道)和电子的自旋状态来描述。
述,换言之,用原子轨道(或轨道)和电子的自旋状态来描述。
⑵能层(电子层、用主量子数n表示):按核外电子能量的高低及离核平均距离的远近,把核外电子的运动区域分为不同的能层(电子层)。目前n的取值为1、2、3、4、5、6、7,对应的符号是英文字母K、L、M、N、O、P、Q。一般地说:n值越大,电子离核的平均距离越远、能量越高,即E(n=1)<E(n=2)<E(n=3)<E(n=4)<……。
⑶能级(电子亚层、用角量子数l表示):在多电子原子中,同一能层(电子层)的电子,能量也可能不同,还可以把它们分为不同的能级或电子亚层(因为这些不同的能量状态的能量是不连续的,像楼梯的台阶一样,因为称为能级)。用角量子数l来描述这些不同的能量状态。对于确定的n值,角量子数l的取值有n个:0、1、2、3、(n-1),分别用s、p、d、f……表示。E(ns)<E(np)<E(nd)<E(nf) <……。
⑷电子云的空间伸展方向(用磁量子数m表示):对于确定的能层和能级(n、l已知),能级的能量相同,但电子云在空间的伸展方向不一定相同,每一个空间伸展方向称为一个轨道,用磁量子数m来描述。不同能层的相同能级,其空间伸展方向数相同,即轨道数相同。
S能级(亚层)是球形,只有1个伸展方向;p能级(亚层)是亚铃形,有3个伸展方向(三维坐标的三个方向);d、f能级(亚层)形状比较复杂,分别有5、7个伸展方向。
⑸原子轨道(或轨道):电子在原子核外出现的空间区域,称为原子轨道。在量子力学中,由能层(电子层、主量子数n)、能级(电子亚层、角量子数l)和电子云的空间伸展方向(磁量子数m)来共同描述。
由于原子轨道由n、l、m决定,由此可以推算出:s、p、d、f能级(亚 层)分别有1、3、5、7个轨道;n=1、2、3、4、…时,其对应电子层包含的轨道数分别为1、4、9、16…,即对于主量子数为n的电子层,其轨道数为n2。
层)分别有1、3、5、7个轨道;n=1、2、3、4、…时,其对应电子层包含的轨道数分别为1、4、9、16…,即对于主量子数为n的电子层,其轨道数为n2。
 ⑹电子的自旋状态:电子只有顺时针和逆时针两种自旋方向,用自旋量子数ms表示。
⑹电子的自旋状态:电子只有顺时针和逆时针两种自旋方向,用自旋量子数ms表示。
|

[例1](2010江苏卷,2)水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为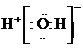
B.4℃时,纯水的pH=7
C.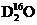 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离 :
: (气态)>
(气态)> (液态)>
(液态)> (固态)
(固态)
[答案]C
[解析]本题主要考查的是有关水的化学基本用语。A项,水是共价化合物,其分子的电子式为 ;B项,温度升高,水的电离程度增大,
;B项,温度升高,水的电离程度增大,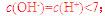 C项,一个
C项,一个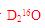
 分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
[例2](河南省方城五高2010届高三上学期期中考试)下列叙述正确的 ( )
A. 14N和15N具有相同的质量数 B. 14N和15N所含的电子数不同
C.N4和N2是同素异形体
D. 14N和N4互为同位素
答案 C
|

第2课时 原子核外电子排布规律
4.核外电子运动状态的形象化描述--电子云:电子在原子核外高速运动,像带负电的“云雾”笼罩在原子核的周围,人们形象地把它叫做电子云。电子云实际上是对电子在原子核外空间某处出现的概率多少的形象化描述,图中的小黑点不表示电子的个数,而是表示电子在该空间出现的机会多少。参见上页“氢原子基态电子云图”。
3.电子运动与宏观物体运动的描述方法的区别
描述宏观物质的运动:计算某时刻的位置、画出运动轨迹等。
描述电子的运动:指出它在空间某区域出现的机会的多少。
2. 核外电子运动特征:在很小的空间内作高速运动,没有确定的轨道。
核外电子运动特征:在很小的空间内作高速运动,没有确定的轨道。
1.原子结构理论的发展。经历了以下五个发展阶段:
①1803年英国化学家道尔顿家建立了原子学说;
②1903年汤姆逊发现了电子建立了“葡萄干布丁”模型;
③1911年英国物理学家卢瑟福根据α粒子散射实验提出原子结构的核式模型;
④1913年丹麦科学家玻尔建立了核外电子分层排布的原子结构模型;
⑤20世纪20年代建立了现代量子力学模型。
3.核外电子
核外电子的运动状态
2. 对于 公式:质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。
公式:质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。
原子可用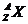 表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n
表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n ;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作
;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作 n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,
n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子, 可写作
可写作 O
O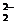 。
。
原子结构及离子结构中各种基本微粒间的关系
|
原子种类 |
微粒之间的关系 |
||
|
中性原子 |
 A AZ |
原子序数=核电荷数=核内质子数= 核外电子数 |
质量数=质子数+中子数 |
|
阳离子 |
 A n+ A n+
|
原子序数=核电荷数=核内质子数=核外电子数+n |
|
|
阴离子 |
 A m- A m-Z |
原子序数=核电荷数=核内质子数=核外电子数-m |
1. 三个基本关系
(1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中)
(2)电性关系:
①原子中:质子数=核电荷数=核外电子数
②阳离子中:质子数>核外电子数 或 质子数=核外电子数+电荷数
③阴离子中:质子数<核外电子数 或 质子数=核外电子数-电荷数
(3)质量关系:质量数 = 质子数 + 中子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com