
5. (09年福建理综·6)下列类型的反应,一定发生电子转移的是
(09年福建理综·6)下列类型的反应,一定发生电子转移的是
 A.化合反应 B.分解反应 C.置换反应 D.复分解反应
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
答案:C
解析:置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。
4.(08年海南化学·4)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为D
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
答案:D
解析:此题主要考查氧化还原反应的配平:Zn+HNO3(稀) Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol。
Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol。
3.(08年广东理基·33)氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C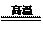 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
答案:B
解析: 该反应中 N2降价为氧化剂,C升价为还原剂,每生成1molAlN转移3mol电子,AlN中Al为+3价,N为-3价。D中摩尔质量的单位为g/mol。
2.(07年广东化学·5)氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1molN2有6mol电子转移
答案:C
解析:本题原理大多同学已在平时练习中接触过,06年高考题实验题21题⑵考到:将NH3通入溴水中,有N2生成,反应的化学方程式为 ,也与此题原理类似属氧化还原反应,故C错。当NH3过量时会与HCl反应生成NH4Cl白烟故A对,反应氯气为氧化剂,NH3为还原剂,氮由-3价升高至0价故生成1molN2有6mol电子转移,D对。
1.(07年山东理综·15)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
答案:B
解析:此题类型属于信息给予题,据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4·H2C2O4·2H2O反应的方程式:
6NaOH+2KHC2O4·H2C2O4·2H2O=3Na2C2O4+K2C2O4+8H2O;
10[KHC2O4·H2C2O4]+8KMnO4+ 17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。可得关系式:6NaOH~2KHC2O4·H2C2O4·2H2O,10[KHC2O4·H2C2O4]~8KMnO4 ;综合以上两式可得:15NaOH ~ 4KMnO4 , 结合题意:V(NaOH)=3V(KMnO4)可得出关系:
15NaOH ~ 4KMnO4
15 4
3V(KMnO4)×0.1000mol·L-1 V(KMnO4)×c(KMnO4)
列式得:15×V(KMnO4)×c(KMnO4)=4×3V(KMnO4)×0.1000mol·L-1,整理得:0.08000mol·L-1,答案选B。
1.Na2CO3+HCl===NaHCO3+NaCl;Ⅱ.NaHCO3+HCl===NaCl+H2O+CO2↑
试根据以上信息回答下列问题:
(1)醋酸可以使紫色石蕊试液变 ▲ ;
(2)根据信息①可知醋酸应置于阴凉处 ▲ 保存;
(3)试写出醋酸与纯碱第一步反应的化学方程式: ▲ ;
(4)他们向纯碱溶液中滴加醋酸到不再产生气泡后,将所得溶液蒸发结晶,获得了少量白色固体。王刚认为这就是纯净的NaAc,而程明则认为里面含有HAc。你认为 ▲ 的观点正确,理由是: ▲ 。
常州市2009年初中毕业、升学统一考试
31.(6分)程明和王刚不小心将纯碱洒到白醋(其有效成分为醋酸,可用HAc表示)里,发现有大量气泡产生,这使他们对醋酸产生了新认识:醋酸像盐酸一样,能与纯碱反应;此外,他们通过查阅相关资料,还检索到以下信息:①醋酸与盐酸都具有较强挥发性;②醋酸是一种有机酸,具有酸的通性,且其钠盐(NaAc)受热不易分解;③盐酸与纯碱的反应分以下两步进行:
30.(6分)雨水资源化是一种发展趋势,2008年奥运会所使用的奥运场馆都建立了雨水利用系统,大大提高了雨水利用率。
(1)雨水在降落过程中常受NO2、SO2的污染形成酸雨。若要测定某雨水酸度,可使用 ▲
(2)雨水受到SO2污染时,将发生SO2与水的反应,写出该反应的化学方程式: ▲ ;空气中的SO2主要来源于 ▲
(3)收集的地面雨水常携带树叶、塑料袋等不溶杂物,处理雨水时应进行沉降、 ▲ ;
(4)要使主要受SO2污染的酸雨可被回收利用,必须对其酸性进行中和,你认为以下较为 经济有效的方法是加入适量的 ▲ 固体(填序号)。
A.NaOH B.Ca(OH)2 C.CaCl2 D.Na2CO3
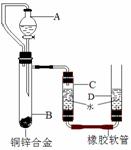
29.(5分)为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉未于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如右图。
试通过计完成下列填空:(不能整除时,结果保留一位小数)
(1)该实验取用的样品质量为:_▲_;
(2)样品中铁的质量分数为: _▲_;
(3)小王不慎在反应结束后,向烧杯中多加了20g稀硫酸,此时,溶液中亚铁离子在溶液总质量中的质量分数为: ▲ ,若在上图中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的_▲_(填:上方、下方或线上)。
28.(9分)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
 ①连接装置并检查装置气密性;
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com