
答案:(1)不变(2)变为原来的2倍(3)变为原来的2倍(4)变为原来的2倍(5)变为原来的2倍(6)变为原来的0.5倍(7)变为原来的0.5倍(8)不变
【例2】下列说法中,正确的是( )
A.KOH的摩尔质量是
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量在数值上等于它的相对原子质量
解析:摩尔质量的单位应当是g/mol,而不是g,故A不对;碳原子的相对原子质量是指拿一个碳原子质量除以一个
答案D
(7) 溶质的物质的量浓度(CB)=溶质的物质的量(n)/溶液的体积(V),在单位体积的98%(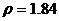 )硫酸中所含溶质――硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
)硫酸中所含溶质――硫酸的质量是不变的,但由(6)中所述可知,其物质的量(n)变成了原来的一半,故物质的量浓度变为原来的0.5倍;
(8) 不论作为相对原子质量的标准如何变化,单个CO2分子的质量并未变化,故一定质量的CO2所含的分子个数是不会发生变化的。
(3)原来所称摩尔质量,实质上是指1摩尔物质的质量即6.02×1023个微粒集体的质量,当作出了上述规定后,1摩尔所含的粒子数已经变成了原来的2倍,故其质量也就为原来的2倍;
(4) 原来氧分子的相对分子质量=氧分子的质量/
(5)气体摩尔体积是指在一定的温度和压强下, 阿伏加德罗常数个气体分子所占有的体积,由于阿伏加德罗常数已经变成了原来的2倍,气体摩尔体积当然也就是原来的2倍了;
(6)根据公式:物质的量(n)=物质的质量(m)/物质的摩尔质量(M),在新的条件下由于摩尔质量变成了原来摩尔质量的2倍,等质量的物质的“物质的量”则等于原来的一半;
(2)原来是以
(7)98%(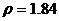 )硫酸的物质的量浓度
(8)44gCO2所含的分子个数
)硫酸的物质的量浓度
(8)44gCO2所含的分子个数
解析:(1)在规定
(4)O2的相对分子质量 (5)气体摩尔体积
(6)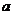 g C2H5OH的物质的量
g C2H5OH的物质的量
【例1】如果我们规定
(1)一个
V溶液(L)
请你将上述关系图的转化方法标出来。
试题枚举

 粒子数(N)
物质的量(n)
物质的质量(g)
粒子数(N)
物质的量(n)
物质的质量(g)
 V气体(标准状态)(L)
V气体(标准状态)(L)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com