
C. 相同状况下,同体积的A与B的质量之比为
B. 同质量的A与B所含分子数之比为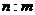
A. A与B相对分子质量之比为
(4)26.
【例4】有一真空储气瓶,净重
A. 44
B.
解析:本题题给条件应当说是“同温、同压、同体积(同一个真空瓶)”,所以不论装什么气体,里面所含气体的物质的量是相同的,根据物质的量(n)=物质的质量(m)/物质的摩尔质量(M)可以得到计算式:(508―500)/32=(511―500)/ M,所以M=44。
答案:A
【变式】标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是
(3)计算出下列物质的质量0.2mol Na2CO3 ;0.3mol NH4HCO3
【变式】(1)(NH4)2SO4的摩尔质量为
。现有26.
(2)计算
NaHCO3 SO3
解析:]根据摩尔的定义,每摩尔物质含有阿伏加德罗常数(NA)个微粒,所以A组答案是正确的,氮气是双原子分子,而氩气是单原子分子,
C.
D.
解析: 根据质量守恒定律可知,
【例3】用NA表示阿佛加德罗常数,下列说法中正确的是( )
A.1mol甲烷的质量与NA个甲烷分子的质量之和相等
B.
【变式】在一定条件下,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com