
1.金属腐蚀的实质:金属原子失去电子被氧化而消耗的过程。
3.两电极浸入电解质溶液且用导线连接或直接接触。
二、金属的腐蚀
2.要有电解质溶液;
1.要有活动性不同的两个电极(一种金属与另一种金属或石墨或不溶性的金属氧化物);
讨论解释其原因:同学甲:实验中存在Mg(OH)2的溶解、结晶平衡: Mg(OH)2(固)  Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O
Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O NH3?H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
NH3?H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同学的解释合理;向盛有少量Mg(OH)2悬浊液的培养皿中加入CH3COONH4 固体,观察悬浊液是否变澄清。CH3COONH4属弱酸弱碱盐,虽强烈水解但溶液呈中性。同时,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2没有溶解,说明甲同学的解释正确。若Mg(OH)2溶解,则说明乙同学的解释正确;因为Mg(OH)2比 NH3? H2O的碱性强。
方案(3)将 0.1mol/L NH3? H2O与0.1mol/L盐酸等体积混合,再滴加石蕊试剂,溶液显红色,说明NH4+水解破坏了水的电离平衡,从而说明氨水是弱碱。
[变式]解释说明化学事实:向盛有少量Mg(OH)2 悬浊液培养皿中加入适量的饱和氯化铵溶液。现象
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化铵晶体、0.1mol/L盐酸、熟石灰和蒸馏水,若仅用上述试剂怎样用简单实验方法证明氨水是弱碱?并指出是通过什么途径证明氨水是弱碱的?
解析:证明氨水是弱碱,可通过两条途径:一是证明氨水中存在电离平衡,如方案(1)。另一是证明NH4+作为弱碱阳离子能破坏水的电离平衡发生水解反应,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈红色,然后向其中加人少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,氨水为弱碱。
方案(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液显红色,说明NH4+水解生成了NH3?H2O和HCl,从而破坏了水的电离平衡,亦说明氨水是弱碱。
解析:0.1 mol?L-1的强酸pH=1.0,0.1
mol?L-1的H HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H
H H
H H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c(OH-)+
答案: C
[例4]
化合物SOCl2是一种液态化合物,沸点
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3?6H2O混合共热,可得到无水AlCl3,原因是________________。
解析:水解的本质是化合物中带正电的基团结合水中电离产生的OH-,而带负电部分结合水中电离产生的H+。据题给信息分析,产生的刺激性气体应是SO2,它是由SO2+结合OH-转化成H2SO3,而另一带负电的Cl-结合水电离的H+生成HCl,与AgNO3反应生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因为蒸干AlCl3溶液时,由于AlCl3水解生成的HCl易挥发,而得到Al(OH)3,但当与SOCl2混合共热时,由于SOCl2极易吸水,防止了AlCl3的水解,有关的化学方程式为6SOCl2+AlCl3?6H2O====6SO2↑+AlCl3+12HCl
[例3] 已知0.1 mol?L-1的二元酸H
A.在Na
B.在溶质物质的量相等的Na
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+
D.在Na
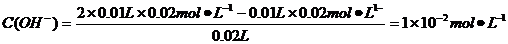
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(HA-)+c(H
答案:BC
[例2] (2006四川,12)
A.c(NH4+)==c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)==c(H+)+c(NH4+)
解析: 氨水与稀硫酸反应,至溶液呈中性,即c(H+)=c(OH-);根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+
答案: B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com