
1.构造原理:绝大多数基态原子核外电子的排布都遵循下列顺序:
1s、2s、2p、3s、3p、 、 、4p、5s、4d、5p、6s、
构造原理揭示了原子核外电子的能级分布。从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(
构造原理是书写基态原子电子排布式的依据,也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。
思考:如何快速判断不同能级的能量高低?
【解析】 要善于抓住题示信息,“黑色褪去而银不会损失”,必然发生变化:Ag2S Ag,显然这是原电池的正极反应,Ag2S+2e-
Ag,显然这是原电池的正极反应,Ag2S+2e-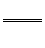 2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-
2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-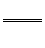 Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O
Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O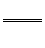 2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O
2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O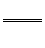 6Ag+2Al(OH)3↓+3H2S↑。
6Ag+2Al(OH)3↓+3H2S↑。
A:原电池负极反应式为: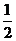 H2+OH-+e-
H2+OH-+e- Ni(OH)2,pH下降。故A不正确。
Ni(OH)2,pH下降。故A不正确。
B:原电池,NiO(OH)→Ni(OH)2,镍被还原。故B也不正确。同理可判断得:正确答案为CD。
【例2】 银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
 【解析】 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
【解析】 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
2Al2O3 4Al+3O2↑
4Al+3O2↑
试题枚举
2NaCl 2Na+Cl2↑
2Na+Cl2↑
电解质本身
Al2O3(熔融)
2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
降低
NaCl(熔融)
离子化合物
2NaCl+2H2O H2+2NaOH+Cl2↑www .k s5u.c om
H2+2NaOH+Cl2↑www .k s5u.c om
电解质与水
升高
CuSO4溶液
不活泼金属的含氧酸盐
2HCl H2↑+Cl2↑
H2↑+Cl2↑
升高
NaCl溶液
活泼金属的无氧酸盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com