
1.证明:
证法1: 设  ,
, ,
,
则:
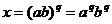
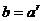
∴ 从而
从而 
∵
 ∴
∴ 即:
即: (获证)
(获证)
证法2: 由换底公式
左边= =右边
=右边
①已知
 9 = a ,
9 = a ,  = 5 , 用 a, b 表示
= 5 , 用 a, b 表示 45
45
解:∵
 9 = a ∴
9 = a ∴ ∴
∴ 2 = 1-a
2 = 1-a
∵  = 5 ∴
= 5 ∴  5 = b
5 = b
∴ 
②若 3 = p ,
3 = p ,  5 = q , 求 lg 5
5 = q , 求 lg 5
解:∵
 3 = p ∴
3 = p ∴ =p
=p 
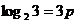


又∵ ∴
∴ 

例1 已知  3 = a,
3 = a,  7 = b, 用 a, b 表示
7 = b, 用 a, b 表示 56
56
解:因为 3 = a,则
3 = a,则 , 又∵
, 又∵ 7 = b,
7 = b,
∴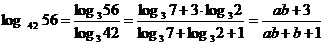
例2计算:① ②
② 

解:①原式 = 

②原式
= 

例3设 且
且
1° 求证  ; 2° 比较
; 2° 比较 的大小
的大小
证明1°:设 ∵
∵ ∴
∴
取对数得: ,
,  ,
, 
∴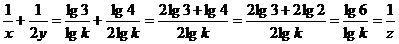
2° 
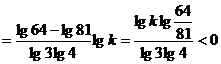
∴
又:

∴
∴

例4已知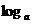 x=
x=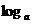 c+b,求x
c+b,求x
分析:由于x作为真数,故可直接利用对数定义求解;另外,由于等式右端为两实数和的形式,b的存在使变形产生困难,故可考虑将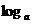 c移到等式左端,或者将b变为对数形式
c移到等式左端,或者将b变为对数形式
解法一:
由对数定义可知: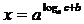

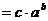

解法二:
由已知移项可得 ,即
,即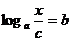

由对数定义知:


解法三:

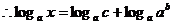


2.两个常用的推论:
① ,
, 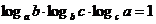

② 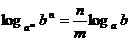 ( a, b > 0且均不为1)
( a, b > 0且均不为1)
证:①

②

1.对数换底公式:
 ( a > 0 ,a ¹ 1 ,m > 0 ,m ¹ 1,N>0)
( a > 0 ,a ¹ 1 ,m > 0 ,m ¹ 1,N>0)

证明:设 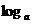 N = x , 则
N = x , 则  = N
= N 
两边取以m 为底的对数:
从而得: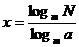 ∴
∴ 

如果 a > 0,a ¹ 1,M > 0, N > 0 有:

3.光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(基态→激发态)能量,产生不同的光谱--原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
试题枚举
[例1]下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
解析: 电子云是对电子运动的形象化描述,它仅表示电子在某一区域内出现的概率,并非原子核真被电子云雾所包裹,故选项A错误。原子轨道是电子出现的概率约为90%的空间轮廓,它表明电子在这一区域内出现的机会大,在此区域外出现的机会少,故选项B错误。无论能层序数n怎样变化,每个p能级都是3个原子轨道且相互垂直,故选项C错误。由于按1p、2p、3p……的顺序,电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展,原子轨道的平均半径逐渐增大。
答案: D
[例2]下列有关认识正确的是( )
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
解析:各能层的能级都是从s能级开始,但不是至f能级结束,如L能层只有2s、2p两个能级,B错误;各能层含有的能级数与能层一致,以C不对;各能层最多容纳电子数为2n2,而不是必须含有的电子数2n2
答案:A
[例3]以下电子排布式表示基态原子电子排布的是( )
A.1s22s22p63s13p3 B.1s22s22p63s23p63d104s1 4p1
C.1s22s22p63s23p63d24s1 D.1s22s22p63s23p63d104s2 4p1
解析:A B C均不符合能量最低原理,选D
答案:D
[例4]人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,错误的是( )
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子”
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
解析:s p d f 能级所含轨道数分别为1、3、5、7,均为奇数,而电子电子排布在同一能级的各个轨道时,优先占据不同的轨道,如两电子占据2p轨道分别占据两个轨道,形成两个未成对电子
答案: B D
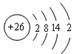
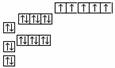
[例5]以下是表示铁原子和铁离子的3种不同化学用语。
|
|
结构示意图 |
电子排布式 |
电子排布图(轨道表示式) |
|
铁原子 |
 |
1s22s22p63s23p63d64s2 |
 |
|
铁离子 |
 |
1s22s22p63s23p63d5 |
 |
⑴铁原子最外层电子数为 ,铁在发生化学反应时,参加反应的电子可能是 。
⑵请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。
答案:⑴2 4s上的2个电子或4s上的2个电子和3d上的1个电子
⑵结构示意图:能直观地反映核内的质子数和核外的电子层数及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数。
轨道表示式:能反映各轨道的能量的高低及各轨道上的电子分布情况,自旋方向。
[例6]下图是锂、氦、汞的吸收光谱和发射光谱。其中图_____________是原子由基态转化为激发态时的光谱,图____________是原子由激发态转化为基态时的光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。

2.激发态:较高能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
1.基态:最低能量状态。如处于最低能量状态的原子称为基态原子。
4.洪特规则:电子排布在同一能级的各个轨道时,优先占据 轨道,且自旋方向 。
思考:为什么在同一原子中不可能出现运动状态完全相同的两个电子?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com