
所以有:4×(11×X/8+0.0800)=1-0.0800-X
O2的总体积为:(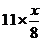 +0.0800) ; N2的总体积为:
+0.0800) ; N2的总体积为: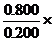 (
(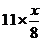 +0.0800);若混合气体的总体积为1,则N2的总体积也可表示为:1-0.0800-X
+0.0800);若混合气体的总体积为1,则N2的总体积也可表示为:1-0.0800-X
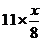 x
x
生成的气体体积为: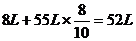
(3)设SO2为X(体积分数),
11O2 → 8SO2
11 8
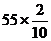 L
y y=
L
y y=
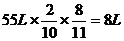
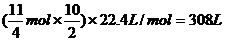
(2)11O2 → 8SO2
11 8
1 mol 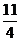 mol
mol
命题意图:主要考查对元素化合物知识与生产实际的联系,考查学生严密的分析能力、和逆向思维能力及完整的解综合试题的能力,该题是图、数结合的由若干小题组合的综合计算,逐题深入,灵活性强,意在考查学生分析问题和解决问题的实际能力。
解析:(1)4FeS2 → 11O2
4 11 所需O2体积为:
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为
① 写出a和b的关系式
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
说明:为方便作图,纵坐标用13b表示
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L
(2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com