
4.(上海部分区县2008年11月高 三 调 研 测 试)将a mol Na和amol Al一同投入m g足量水中,所得溶液密度为dg·㎝-3,该溶液的质量分数为 ( )
A.82a /(46a + m)% B. 82000a /(46a + 2m)%
C.8200a /(46a + m)% D. 8200a /(69a +2 m)%
[解析]由反应2Na + 2H2O =2NaOH +H2↑;2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑,知产生NaAlO2a mol,H22amol,溶质为82a g;溶液为(23a + 27a-2×2a)=46a + m。即可算出NaAlO2溶液质量分数。
[答案]C
3.(2008惠州三模)某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则
A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 %
[解析]若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则压强不影响平衡状态,a=1;A(g)+B(g) C(g)+D(g),
C(g)+D(g),
起始物质的量(mol) 2 3 0 0
变化物质的量(mol) x x x x
平衡物质的量(mol)2-x 3-x x x
K=1=x2/[(2-x)( 3-x)] ,X=1.2,则B的转化率为1.2/3=40%
[答案]AC
2.(江苏春晖中学高三年级2008学年第一学期十二月月考)设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法正确的是
A.氯元素的相对原子质量为12/b B.mg该氯原子的物质的量为m / NA mol
C.该氯原子的摩尔质量是a NA D.ng该氯原子所含的电子数是17n/a
[解析]根据相对原子质量的定义,氯元素的相对原子质量=ag/(bg/12)= 12a/b,AC错;
mg该氯原子的物质的量=mg/(12a/b)g.mol-1==mb/12amol,B错;
[答案]D
1.(安徽省潜山县黄铺中学2009届高三化学调研)已知下列热化学方程式:
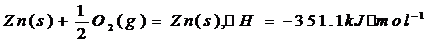
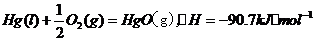
由此可知热化学方程式Zn(S)+HgO(g)=ZnO(S)+Hg(l)的反应热△H3为
A.-441 kJ·mol-1 B.-254 kJ·mol-1 C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
[解析]根据盖斯定律
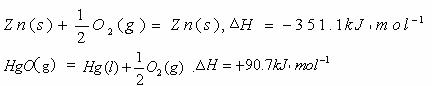
上述两个方程式加和得:Zn(S)+HgO(g)=ZnO(S)+Hg(l),△H=-260.4 kJ·mol-1
[答案]D
21.(09福建卷 25)
25) 某研究性小组借助A-D的仪器装置完成有关实
某研究性小组借助A-D的仪器装置完成有关实
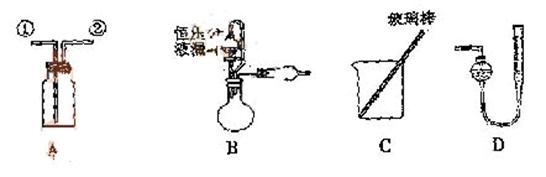
 [实验一]收集NO气体。
[实验一]收集NO气体。
 (1)用装置A收集NO气体,正确的操作是 (填序号)。
(1)用装置A收集NO气体,正确的操作是 (填序号)。
 a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
 [实验二]为了探究镀锌薄铁板上的锌的质量分数
[实验二]为了探究镀锌薄铁板上的锌的质量分数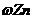 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用B和
(填仪器标号)两个装置进行实验。
(2)选用B和
(填仪器标号)两个装置进行实验。
 (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况),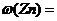 = 。
= 。
 (4)计算镀层厚度,还需要检索的一个物理量是
。
(4)计算镀层厚度,还需要检索的一个物理量是
。
 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
 (6)
(6)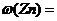 。
。
 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
 (7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
[解析]本题考查实验的探究,涉及NO气体的收集,混合物中金属含量的计算等。
(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出21世纪教育网
(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。
(3)Zn与H2之间量为1:1,则n(Zn)=V/22.4 mol,w (Zn)=m(Zn)/m1
= 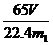 。
。
(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)21世纪教育网
(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。
(6)减少的质量即为Zn的质量21世纪教育网
(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
[答案](1)C
(2)D
(3) 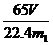 (或
(或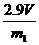 等其他合理答案:)
等其他合理答案:)
(4)金属锌的密度(或其他合理答案:)
(5)偏大
(6)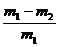 (或其他合理答案:)
(或其他合理答案:)
(7)劣于
[考点分析]本题借助于实验考查质量分数的计算。
[专题突破]
0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平
N2O4(g)的平
衡常数K21世纪教育网
 (4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2
的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
 [解析](1)考查影响化学平衡移动的因素
[解析](1)考查影响化学平衡移动的因素
(2)简单的反应热计算要注意将质量转化为物质的量,还要注意比例关系。
(3)(4)见答案
 [答案](1)BC
[答案](1)BC  (2)-1224.96
(2)-1224.96
 (3)根据题意知平衡时:
(3)根据题意知平衡时: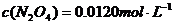 ;
; 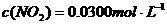
 K=
K=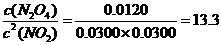
 答:平衡常数为13.3。
答:平衡常数为13.3。
 (4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:
(4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:

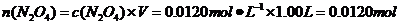

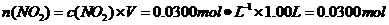
 则
则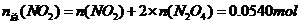
 由
由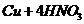 ===
===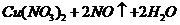 可得
可得

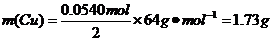
 答:理论上至少需消耗Cu 1.73 g.
答:理论上至少需消耗Cu 1.73 g.
[考点分析]本题主要考查平衡的影响因素、物质的量与质量的转化计算、物质的量应用于化学方程式的计算21世纪教育网
20.(09江苏卷 20)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能
20)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能
放出大量的热。
 (1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
(1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。
 其他条件不变时,下列措施能提高NO2转化率的是
(填字幕)
其他条件不变时,下列措施能提高NO2转化率的是
(填字幕)
 A.减小NO2的浓度
B.降低温度 C.增加NO2的浓度
D.升高温度
A.减小NO2的浓度
B.降低温度 C.增加NO2的浓度
D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=
19.(09全国卷Ⅱ 27)
27)
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,
它们的物质的量随时间的变化如表所示。

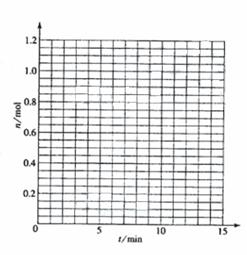
 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |


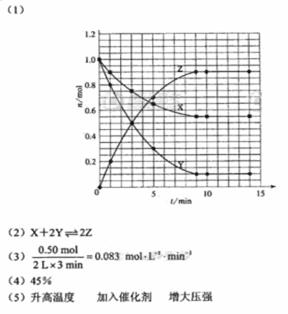
 (2) 体系中发生反应的化学方程式是___________________________;
(2) 体系中发生反应的化学方程式是___________________________;

 (3) 列式计算该反应在0-3min时间内产物Z
(3) 列式计算该反应在0-3min时间内产物Z
的平均反应速率:_______________;

 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率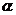
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温
(5) 如果该反应是放热反应。改变实验条件(温
度、压强、催化剂)得到Z随时间变化的曲线
①、②、③(如右图所示)则曲线①、②、③
所对应的实验条件改变分别是:

 ① _________________ ②________________ ③__________________
① _________________ ②________________ ③__________________
[解析
 ](1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
](1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解
 aX + bY
aX + bY cZ
cZ
 开始 1.00 1.00 0
开始 1.00 1.00 0
 转化 0.45 0.9 0.9
转化 0.45 0.9 0.9
 平衡 0.55 0.1 0.9
平衡 0.55 0.1 0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y
根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y 2Z。
2Z。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压21世纪教育网
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压21世纪教育网
[答案]

[考点分析]本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
18.(09宁夏卷 28)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=-99kJ·mol-1.请回答下列问题:
28)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=-99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反
(1)图中A、C分别表示 、 ,E的大小对该反
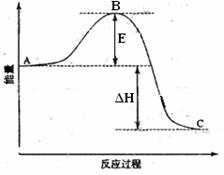 应的反应热有无影响? 。该反应通常用V2O5作催化
应的反应热有无影响? 。该反应通常用V2O5作催化
剂,加V2O5会使图中B点升高还是降低? ,理由
是 ;
 (2)图中△H=
KJ·mol-1;
(2)图中△H=
KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式
;
 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=
mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
 (5)已知单质硫的燃烧热为296
KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296
KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。

 [解析](1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
[解析](1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义,E为活化能与反应热无关,但是用催化剂可以降低活化能;
(2)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1;
(3)依题意即可写出:SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5;
(4)依据速率之比等于化学计量数之比
 [答案](1)反应物能量 生成物能量
[答案](1)反应物能量 生成物能量
无 降低 因为催化剂改变了反应的历程使活化能E降低
(2)-198
(3) SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
 (5) S(s)+O2(g)
=2SO2(g)△H1=-296 KJ·mol-1 , SO2(g)+1/2O2(g)
=SO3(g) △H2=-99 KJ·mol-1
(5) S(s)+O2(g)
=2SO2(g)△H1=-296 KJ·mol-1 , SO2(g)+1/2O2(g)
=SO3(g) △H2=-99 KJ·mol-1
 3 S(s)+9/2O2(g)=3SO3(g)
△H=3(△H1+△H2)=-1185
KJ·mol-1
3 S(s)+9/2O2(g)=3SO3(g)
△H=3(△H1+△H2)=-1185
KJ·mol-1
[考点分析]本题主要考查学生读图能力、焓变计算、化学反应速率的计算能力。
17.(09上海卷 31)烟气中
31)烟气中 是NO和
是NO和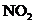 的混合物(不含
的混合物(不含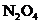 )。
)。
 (1)根据废气排放标准,
(1)根据废气排放标准,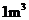 烟气最高允许含400mg
烟气最高允许含400mg 。若
。若 中NO质量分数为0.85,则
中NO质量分数为0.85,则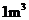 烟气中最高允许含NO__________L(标准状况,保留2位小数)。
烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的
(2)工业上通常用溶质质量分数为0.150的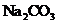 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为 吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L(保留2位小数)。
 (3)已知:
(3)已知: 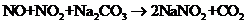 ①
①

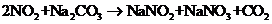 ②
②

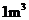 含2000mg
含2000mg 的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______排放标准(填“符合”或“不符合”),理由:____________________。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:
 NO+2HNO3→3NO2+H2O
NO+2HNO3→3NO2+H2O
 当烟气中
当烟气中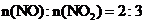 时,吸收率最高。
时,吸收率最高。

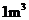 烟气含2000mg
烟气含2000mg ,其中
,其中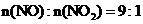 。
。
 计算:(i)为了达到最高吸收率,
计算:(i)为了达到最高吸收率,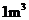 烟气需用硝酸的物质的量(保留3位小数)。
烟气需用硝酸的物质的量(保留3位小数)。
 (ii)
(ii)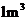 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
[解析及答案 ](1)0.25
](1)0.25  (2)1.64
(2)1.64
 (3)不符合 因吸收后烟气总体积减小,
(3)不符合 因吸收后烟气总体积减小, 含量仍超过
含量仍超过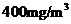
 (4)(i)
(4)(i)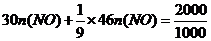
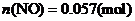

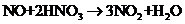

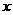
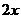
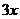

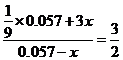
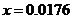
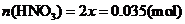
 (ii)
(ii)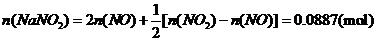

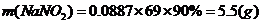
[考点分析]本题主要考查气体体积的计算、物质的量浓度的计算、物质的量应用于化学方程式的计算21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com