
2、电离平衡常数
??(1)概念:在一定条件下,弱电解质的电离达到平衡时,溶液中电离所产生的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数,这个常数叫做电离平衡常数,用K表示(酸用 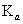 表示,碱用
表示,碱用 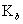 表示)。
表示)。
??(2)表示方法: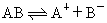
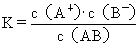
??(3)K的意义:K值越大,表示该电解质较易电离,所对应的弱酸弱碱较强。从 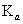 或
或 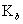 的大小,可以判断弱酸和弱碱的相对强弱,例如弱酸的相对强弱:
的大小,可以判断弱酸和弱碱的相对强弱,例如弱酸的相对强弱:
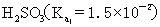 >
> 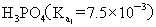 >
> 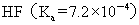 >
> 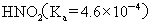 >
> 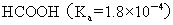 >
> 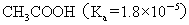 >
> 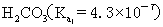 >
> 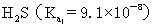
??(4)影响K值大小的因素:K值不随浓度而变化,但随温度而变化。
??(5)多元弱酸的电离。多元弱酸是分步电离的,且越向后的电离越困难,其电离出来的离子浓度也越小,酸性主要由第一步电离决定。如
 的电离:
的电离:
??第一步电离: 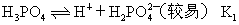
??第二步电离: 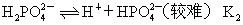
??第三步电离: 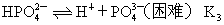
??显然: 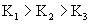 。在磷酸溶液中,由
。在磷酸溶液中,由  电离出来的离子有H+、H2PO4 -、HPO4
2-、PO4 3-等离子,其离子浓度的大小关系为:
电离出来的离子有H+、H2PO4 -、HPO4
2-、PO4 3-等离子,其离子浓度的大小关系为: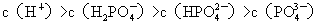 。
。
1、弱电解质的电离平衡指在一定条件下(温度、浓度),弱电解质电离成离子的速率和离子结合成分子的速率相等时的状态。弱电解质的电离平衡的特点是:
(1)动态平衡:电离方程式中用“ 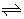 ”,如:CH3COOH
”,如:CH3COOH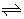 CH3COO-+H+。
CH3COO-+H+。
??(2)条件改变:平衡被打破。如在CH3COOH的石蕊溶液中(呈红色)加入固体CH3COONH4,即增大了c(CH3COO-),平衡左移,c( H+)变小,使红色变浅。
??(3)弱电解质在离子反应中电离平衡发生移动。将等质量的锌粉分别投入10mL0.1mol/L盐酸和10mL0.1mol/L醋酸中,实验结果:盐酸的反应速率比醋酸快。若锌足量,则产生氢气的体积相等。因为当浓度和体积相同时,盐酸是强酸,c(H+)大,所以反应速率快,但二者可电离出来的H+的物质的量相等,仅仅是后者随着反应的进行,醋酸的电离平衡不断发生移动。
??(4)从导电实验可知,弱电解质少部分电离,大部分以分子形式存在,决定了它在离子方程式书写中保留分子形式。如醋酸和烧碱溶液中和反应的离子方程式应写成:CH3COOH+OH-= CH3COO-+H2O。
??(5)导电性强弱与电解质强弱的关系:电解质的强弱由物质内部结构决定,电解质的强弱在一般情况下影响着溶液导电性的强弱。导电性强弱是由溶液离子浓度大小决定的。如果某强电解质溶液浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度很小,但如果浓度较大时,该溶液的导电能力也可以较强。因此,强电解质溶液的导电能力不一定强,弱电解质的导电能力也不一定弱。
|
|
强电解质 |
弱电解质 |
|
定义 |
溶于水后几乎完全电离的电解质 |
溶于水后只有部分电离的电解质 |
|
化合物类型 |
离子化合物及具有强极性键的 共价化合物 |
某些具有弱极性键的共价化合物。 |
|
电离程度 |
几乎100%完全电离 |
只有部分电离 |
|
电离过程 |
不可逆过程,无电离平衡 |
可逆过程,存在电离平衡 |
|
溶液中存在的微粒(水分子不计) |
只有电离出的阴阳离子,不存在 电解质分子 |
既有电离出的阴阳离子,又有电解质分子 |
|
实例 |
绝大多数的盐(包括难溶性盐) 强酸:H2SO4、HCl、HClO4等 强碱:Ba(HO)2 Ca(HO)2等 |
弱酸:H2CO3
、CH3COOH等。 弱碱:NH3·H2O、Cu(OH)2 Fe(OH)3等。 |
|
电离方程式 |
KNO3=K++NO3- H2SO4=2 H++SO42- |
NH3·H2O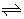 NH4++OH_ NH4++OH_H2S 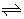 H++HS_ HS_ H++HS_ HS_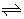 H++S2- H++S2- |
(1)联系调节作用:地球上的各种水体通过蒸发(包括植物蒸腾)、水汽输送、降水、下渗、地表径流和地下径流等一系列过程和环节,把大气圈、水圈、岩石圈和生物圈有机地联系起来,构成一个庞大地水循环系统。
(2)平衡更新作用:在水循环系统中,水在连续不断地运动、转化,使地球上各种水体处于不断更新状态,从而维持全球水地动态平衡。
(3)迁移交换作用:水循环还促使自然界物质地运动和能量的转化,从而使地球表层各圈层之间,以及陆地和海洋之间实现物质的迁移和能量的交换。
(4)影响塑造作用:水循环运动影响着全球的气候和生态,并且使水成为自然界最富动力作用的因子之一,不断地塑造着地表形态。
2.类型及其环节、作用
|
水循环类型 |
发生领域 |
水循环环节 |
作用 |
|
海陆间大循环 |
海洋与陆地之间 |
蒸发、水汽输送、凝结降水、地表径流、下渗、地下径流 |
使陆地水不断得到补充,水资源得以再生,是最重要的水循环,又称大循环 |
|
陆地内循环 |
陆地与陆地上空之间 |
蒸发、植物蒸腾、凝结降水等 |
补给陆地水体的水量为数很少 |
|
海上内循环 |
海洋与海洋上空之间 |
蒸发、凝结、降水等 |
水循环的水量最大,对于全球的热量输送有着重要意义 |
读图P59 水循环示意图
水循环在水圈、大气圈、岩石圈、岩石圈、生物圈四大圈层中通过蒸发、蒸发、植物蒸腾、水汽输送、降水、地表径流、下渗、地下径流等环节连续运动。它发生的领域有:海洋与陆地之间,陆地与陆地上空之间,海洋与海洋上空之间。
从图中还可以看出:
水循环的基本环节有三个:①降水,包括陆地降水和海上降水;②蒸发,包括海上蒸发、陆面蒸发、植物蒸腾;③输送,包括水汽输送和径流输送。
水循环的组成,分为两部分:即大气部分--水汽输送阶段和降水阶段;地面部分--径流阶段与蒸发阶段。每一部分都包含三个方面,即水分输送、暂时储存和状态的变化。关于状态的变化,在大气部分是通过凝结,把气态转变成液态,地面部分是通过蒸发,把液态转变成气态。
水循环把自然界的各部分联系起来,形成一个有机整体。在垂直方向上,通过降水、蒸发、下渗、植物蒸腾等环节,把大气圈、水圈、生物圈、岩石圈联系起来;通过水汽输送的径流输送,把陆地和海洋联系起来。这样就构成一个庞大的水循环系统。
注意:海陆间循环又称为大循环是指该循环环节最多(包括海洋水蒸发、水汽输送、凝结降水、地表径流、下渗、地下径流等)、范围最广(既包括海洋也包括陆地)。而不是指参与的水量,就水循环参与的水量而言,海上内循环是海陆间循环的9倍。
1.概念及领域
自然界的水在水圈、大气圈、岩石圈、生物圈四大圈层中通过各个环节连续运动的过程。
发生的领域:海洋与陆地之间,陆地与陆地上空之间,海洋与海洋上空之间。
2.陆地水体及其相互关系
(1)陆地水是指分布在陆地上的各种水体,包括地下水、河流水、湖泊水、沼泽水、土壤水、地下水、冰川水、生物水等,水量占全球水储量的3。5%。
(2)作用:供应人类生产和生活所需的淡水。
(3)冰川
①冰川是地球淡水的主体。冰川面积约占陆地面积的1/10,水量约占淡水总量2/3。
②冰川主要分布在高纬度两极地区和高山地区。
③作为淡水资源直接加以利用的不多。
(4)陆地各种水体之间水源相互补给关系。
湖沼水

 大气降水 降雨 江河水
融水 冰川
大气降水 降雨 江河水
融水 冰川

 下渗 下渗
下渗 下渗


 地下水
地下水
(包括土壤水)
1.水圈的概念和特点
水在地理环境中以气态、固态和液态三种形式相互转化,形成各种水体,共同构成了一个连续但不规则的圈层。
组成水圈的液态水、气态水、固态水的分布和数量特征可用表格形式比较如下:
|
水的三态 |
分布特点 |
数量特征 |
|
气态水 |
最广 |
最少 |
|
液态水 |
次之 |
最大 |
|
固态水 |
仅在高纬、高山或特殊条件下才能存在 |
地球淡水的主体,水量约占淡水总量的2/3 |
2. 人类活动对水循环的影响。
[教学难点]
水循环的地理意义。
[教学设计]
1. 水循环的形成过程和地理意义。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com