
4.强、弱电解质与物质结构的关系:
强电解质一般为离子化合物和一些含强极性键的共价化合物,弱电解质一般为含弱极性键的化合物。
3.强、弱电解质与溶液导电性的关系:
溶液的 导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
导电性强弱与溶液中的离子浓度大小有关。强电解质溶液的导电性不一定强,如很稀的强电解质溶液,其离子浓度很小,导电性很弱。而弱电解质溶液的导电性不一定弱,如较浓的弱电解质溶液,其电离出的离子浓度可以较大,导电性可以较强。
2.强、弱电解质与溶解性的关系:
电解质的强弱取决于电解质在水溶液中是否完全电离,与溶解度的大小无关。一些难溶的电解质,但溶解的部分能全部电离,则仍属强电解质。如:BaSO4、BaCO3等。
强电解质:在溶液中能够全部电离的电解质。则强电解质溶液中不存在电离平衡。
弱电解质:在溶液中只是部分电离的电解质。则弱电解质溶液中存在电离平衡。
[注意]
1.强、弱电解质的范围:
强电解质:强酸、强碱、绝大多数盐
弱电解质:弱酸、弱碱、水
4.溶剂化作用:电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
3.常见电解质的范围:酸、碱、盐、离子型氧化物。
2.化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。如:SO2、SO3、CO2、NO2等。
电解质:在水溶液里或熔融状态下能导电的化合物。
非电解质:在水溶液里或熔融状态下不能导电的化合物。
[注意]
1.电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。
(二)溶液的pH
1、酸性溶液:按C→CH+→pH
2、碱性溶液:按C→COH-→CH+→pH
3、强酸、强碱溶液的稀释后的溶液:对于酸溶液中的CH+,每稀释10n倍,pH增大n个单位,但增大后不超过7,酸仍为酸!
①对于碱溶液中的COH-,每稀释10 n倍,pH减少n个单位,但减少后不小于7,碱仍为碱!
②pH值相同的强酸与弱酸(或强碱与弱碱),稀释相同的倍数,pH变化为强酸变化大,弱酸变化小。
③极稀溶液中的pH值的计算,应考虑水的电离。
4、强酸与强弱溶液混合的计算: 反应的实质:H++OH-=H2O
三种情况:(1)恰好中和,pH=7 (2)若余酸,先求中和后的CH+,再求pH。 (3)若余碱,先求中和后的COH-,再通过KW求出CH+,最后求pH。
5、已知酸和碱溶液的pH之和,判断等体积混合后的溶液的p H
(1)若强酸与强碱溶液的pH之和大于14,则混合后显碱性,pH大于7。
(2)若强酸与强碱溶液的pH之和等于14,则混合后显中性,pH等于7。
(3)若强酸与强碱溶液的pH之和小于14,则混合后显酸性,pH小于7。
(4)若酸与碱溶液的pH之和等于14,强、碱中有一强、一弱,则酸、碱溶液混合后,谁弱显谁性。这是因为酸和碱已电离的H+ 和OH- 恰好中和,谁弱谁的H+ 或OH- 有储备,中和后还能电离,显出酸、碱性来。

第1课时 强弱电解质
教材在讲述电解质的有关概念时,跨度较大,必修1的第二章第二节讲述了电解质的概念,选修《化学反应原理》第三章第一节、第二节讲述了强、弱电解质的有关概念。
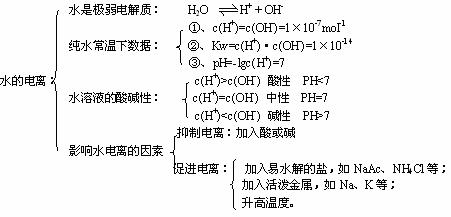
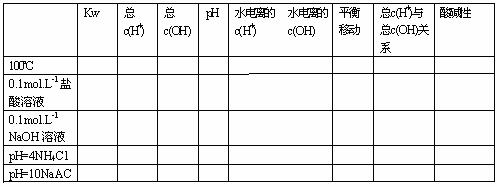
(一)水的电离
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com