
2.胶体的分类
按分散质的组成分为:
粒子胶体:如Fe(OH)3胶体,Al(OH)3胶体
分子胶体:如蛋白质溶于水所得分散系,淀粉溶于水所得分散系
按分散剂的状态分成:
液溶胶:如Na2SiO3溶于水所得分散系,肥皂水
固溶胶:有色玻璃
气溶胶:烟、云、雾
1.定义:分散质的大小介于1 nm-100 nm之间的分散系叫做胶体。
3.溶解度及相关计算
固体溶解度(S)指的是在一定条件下,100克溶剂中溶解某溶质达到饱和状态时所溶解溶质的克数叫做该条件下该溶质在该溶剂中的溶解度。

气体的溶解度是指在一定温度下,某气体(压强为1标准大气压)在1体积溶剂里达到饱和状态时所溶解的体积数。例如:0℃、1大气压下,氧气的溶解度为0.049,表示该条件下1体积水中最多能溶解0.049体积的氧气。气体的溶解度是没有单位的。(0℃时,NH3的溶解度是1176;20℃时为702)
物质溶解度的大小主要决定于溶质和溶剂的性质(内因),外界条件如温度、压强对物质的溶解度也有一定的影响(外因)。
(1)温度对固体物质溶解度的影响:
大部分固体物质的溶解度随着温度的升高而增大;少数物质(如食盐)的溶解度受温度的影响很小;还有极少数物质(如熟石灰)的溶解度随温度的升高而减小。
例1:40℃时等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO并保持温度仍为40℃。这两种情况都不改变的是( )
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶液的质量分数 D.溶液中Ca2+数目
解析:正确答案为C。Ca(OH)2的溶解度随温度的降低而增大,故所给溶液冷却至10℃时,溶液变得不饱和,溶液的质量、质量分数,溶液中Ca2+数目皆不变;而加入CaO时发生反应CaO+H2O==Ca(OH)2,水量减少,因温度不变时溶解度不变,故有Ca(OH)2析出,溶液质量、Ca2+数目都减少,但仍为饱和溶液,质量分数不变。
(2)温度、压强对气体溶解度的影响:
气体的溶解度一般随着温度的升高而减小(如氨水受热逸出氨气);当温度不变时,随着压强的增大,气体的溶解度增大;随着压强的降低,气体溶解度减小。(如打开汽水瓶盖即冒气泡。)
例2:下列有关溶液性质的叙述,正确的是( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100 g水中可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100 g水中溶入氧气的质量增加
解析:正确答案选D。气体的溶解度一般随温度的升高而减小,故室温下CO2的饱和水溶液在降温到0℃时不会放出气体;20℃时34.2 g KCl溶于100 g H2O中所得饱和溶液的质量分数为 ×100%=25.5%;物质在水中溶解度的大小与电解质的强弱无必然联系,如CaCO3等难溶性盐虽为强电解质,但其溶解度不大,而CH3COOH等弱电解质在水中的溶解度却较大。水面上的O2与水面下的溶入氧存在溶解平衡,水面O2浓度增大,平衡向水面下溶入氧的方向移动,故100 g水中溶入O2的质量增加。
物质的溶解度和温度的关系,可用溶解度曲线来表示。纵坐标表示溶解度,横坐标表示温度,曲线上任何一点表示这种物质在该温度下的溶解度。
根据某物质的溶解度曲线可以查知这种物质在某温度时的溶解度,也可以看出这种物质的溶解度随着温度的变化而变化的规律,还可以比较温度相同时不同物质溶解度的大小。
一定条件下的饱和溶液中,溶质与溶剂的质量比是固定不变的,因此,对于一定条件下的饱和溶液有下列基本关系:
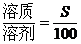
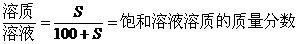
(1)温度不变时,饱和溶液蒸发溶剂或向饱和溶液中加入溶剂时,析出或溶解溶质(达到饱和)的质量x:
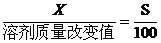
(2)若溶剂不变,改变温度,求析出或溶解溶质(达到饱和)的质量x:
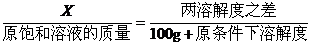
例3:把一定量20%的某物质的溶液加热蒸发掉10克水,在冷却到20℃时析出2克溶质,此时溶液的质量百分比浓度为24%,求20℃时溶质在水中的溶解度。
解析:设20℃时溶质在水中的溶解度为S,则: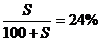 S=31.6克
S=31.6克
例4:一定温度下浓度为a%的硝酸钾溶液,将其等分为两份,一份等温蒸发掉10克水,得到0.5克晶体;另一份等温蒸发掉12.5克水,析出1.5克晶体。该温度下硝酸钾的溶解度为( )
A.60克 B.50克 C.40克 D.30克
解析:正确答案选C。蒸发溶液有晶体析出时,说明此时溶液已达饱和,第2份溶液比第1份溶液多蒸发掉2.5克水,多析出1克溶质,说明饱和溶液每蒸发掉2.5克水,析出1克溶质,所以: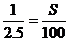 S=40克
S=40克
2.溶液的分类:
(1)按状态分
固体“溶液”:例如合金
液体“溶液”:例如水溶液
气体“溶液”:例如空气
(2)按饱和程度分
饱和溶液:一定温度下一定量的溶液不能再溶解某溶质时叫做这种溶质的饱和溶液。
不饱和溶液:一定温度下一定量的溶液还能继续溶解某溶质时叫做这种溶质的不饱和溶液。
1.概念:一种或几种物质分散到另一种物质里所形成的均一的稳定的混合物叫做溶液。
溶质:被溶解的物质(即分散质)
溶剂:能溶解其他物质的物质(即分散剂)。
说明:
(1)溶液是分散系中的一种,其分散质被分散成分子或离子,大小为1 nm以下。
(2)溶液的特点是:均一、稳定、多为透明。
(3)常用的溶剂:
无机溶剂:H2O,NH3(液),HF(液)等。
有机溶剂:C2H5OH,C2H5OC2H5,丙酮,苯,CCl4,氯仿(CHCl3),CS2,汽油等。
2.三种分散系比较
|
分散系 |
溶液 |
胶体 |
浊液 |
|
分散质微粒直径 |
<10-9m |
10-9m-10-7m |
>10-7m |
|
外观 |
均一、透明、稳定 |
多数均一、透明、稳定 |
不均一、不透明、不稳定 |
|
分散质微粒组成 |
单个分子或离子 |
分子集合体或有机高分子 |
许多分子集合体 |
|
能否透过滤纸 |
能 |
能 |
不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
实例 |
食盐水、碘酒 |
肥皂水、淀粉溶液 |
泥水 |
1.分散系
物质的粒子分散于另一物质里所组成的体系叫分散系。其中被分散的物质称做分散质,分散其他物质的物质称做分散剂。即:分散系=分散质十分散剂
分散系包括:溶液、胶体和浊液。
3.人们对苯及芳香烃的认识有一个不断深化的过程。
 (1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式
。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式
。
(2)已知分子式为 C6H6 的结构有多种,其中的两种为

① 这两种结构的区别表现在:定性方面(即化学性质方面):Ⅱ能_______(选填a、b、c、d,多选扣分)而Ⅰ不能。
a.被酸性高锰酸钾溶液氧化 b.能与溴水发生加成反c.能与溴发生取代反应 d.能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ 需 _______mol。
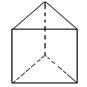
② 今发现 C6H6 还可能有另一种如右图立体结构:该结构的二氯代物有_______种。
(3)萘 也是一种芳香烃,它的分子式是 C10H8 ,请你判断它的结构简式可能是下列中的_____(填入编号)
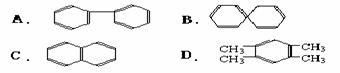 (4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列 事实(填入编号)
(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列 事实(填入编号)
a. 萘不能使溴水褪色 b. 萘能与H2发生加成反应 c. 萘分子中所有原子在同一平面 d.一溴代萘(C10H7Br)只有两种
2.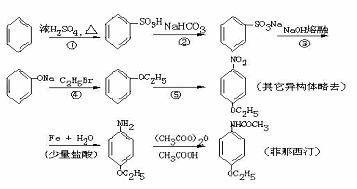 药物菲那西汀的一种合成路线如下:
药物菲那西汀的一种合成路线如下:
反应②中生成的无机物的化学式是 ,反应③中生成的无机物的化学式是 ,反应⑤的化学方程式是 ;菲那西汀水解的化学方程式是 。
1.(03年上海高考题)自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
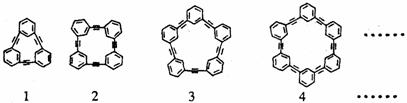
(1)上述系列中第1种物质的分子式为 。
(2)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(3)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com