
1.下列属于商品的有( )
①自来水 ②农民种的菜 ③氧气 ④有线电视节目 ⑤人民币
A、① ④ B、① ④ ⑤ C、① ② ③ ④ D、① ② ③ ④ ⑤
(七)厂址选择:从海水中提取镁的工厂就设在海边,需要的碱取自海边丰富的贝壳CaCO3,CaCO3分解后生成的CaO再与水反应即得碱Ca(OH)2。电解MgCl2时产生的Cl2又可作为制盐酸的原料,制得的盐酸再跟Mg(OH)2反应制取MgCl2又进入循环,提高了综合经济效益。
[思考感悟]
 做镁条在空气中燃烧的实验时,用纯净的镁条和纯净的空气,燃烧产物是纯净物还是混合物?为什么?
做镁条在空气中燃烧的实验时,用纯净的镁条和纯净的空气,燃烧产物是纯净物还是混合物?为什么?

 镁条在空气中燃烧时,与空气中的O2、N2发生反应,2Mg+O2 2MgO(主要产物),3Mg+N2 Mg3N2(少量),故燃烧后的产物是混合物。注意:基本上无Mg+CO2 2MgO+C,因CO2在空气中的含量极少(0.03%)。
镁条在空气中燃烧时,与空气中的O2、N2发生反应,2Mg+O2 2MgO(主要产物),3Mg+N2 Mg3N2(少量),故燃烧后的产物是混合物。注意:基本上无Mg+CO2 2MgO+C,因CO2在空气中的含量极少(0.03%)。
[基础训练]
1、某学生设计如图装置,验证Na2O2(只含杂质Na2O)与CO2反应产生O2并测定Na2O2的纯度。整套装置气密性良好,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料。
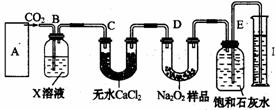 (1)写出在实验中Na2O2和Na2O分别与CO2发
(1)写出在实验中Na2O2和Na2O分别与CO2发
生反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
Na2O+CO2=Na2CO3。
(2)B装置中最好盛放饱和NaHCO3溶液,其作
用是吸收CO2中HCl;若无C装置,则会造成E中即
使产生O2也不能证明是Na2O2和CO2反应产生的O2,
且会使Na2O2的百分含量增大。
(3)若E中澄清石灰水出现轻微白色浑浊,可能的原因是未反应完的CO2与澄清石灰水反应生成难溶的CaCO3;为检验E中收集到气体为O2。其操作为:关闭CO2发生装置,打开E装置双孔塞,立即用带火星的木条伸入其中观察木条是否复燃。
(4)测定收集气体体积包括如下几个步骤。
①调整量筒I与E中的液面相平;②使整个装置内气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是②①③(填步骤代号)。
(5)实验结束时,量筒I中有水VmL,又知此条件下氧气的密度为1.43g·L-1,则Na2O2的质量分数计算式为w(Na2O2)=1.43×2×78V/(1000×32×1.95)(含V)。这种测定法一般会比用Na2O2样品与HCl反应的方法测定结果偏低,其原因可能为部分氧气溶解。
(6)该学生为使测定结果更准确,在原装置不变的情况下适当做了改进,你认为是石灰水改为NaOH溶液。
2、镁粉在焰火、闪光粉、鞭炮中是不可少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气;②CO2;③Ar;④H2;⑤N2。其中可作为冷却气的是( C )
A、①② B、②③ C、③④ D、④⑤
3、 近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等。这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上出发设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行并且符合“绿色化学”要求的方案是( C )
近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等。这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上出发设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行并且符合“绿色化学”要求的方案是( C )
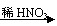
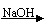
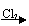 A、Mg Mg(NO3)2
A、Mg Mg(NO3)2
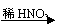
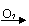 B、Mg MgCl2 Mg(OH)2
Mg(NO3)2
B、Mg MgCl2 Mg(OH)2
Mg(NO3)2
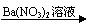
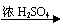 C、Mg MgO Mg(NO3)2
C、Mg MgO Mg(NO3)2
D、Mg MgSO4 Mg(NO3)2
[高考模拟]
4、(2008北京理综7)1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( A )
A、Na2CO3 B、Na2O2,Na2CO3
C、NaOH,Na2CO3 D、Na2O2,NaOH,Na2CO3
5、(2008上海化学13)已知在热的碱性溶液中NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( B )
A、NaCl、NaClO B、NaCl、NaClO3 C、NaClO、NaClO3 D、NaClO3、NaClO4
[作业]
(六)电解:生成的Cl2可用于制盐酸;
(四)蒸发结晶;(五)干燥;
(二)沉淀;(三)酸化;
(一)制碱:CaCO3 CaO+CO2↑,CaO+H2O=Ca(OH)2。
(三)用途
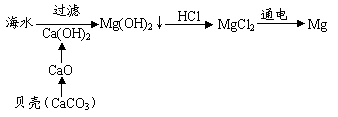 镁与其他金属构成合金,强度较大、机械性能良好,是制造汽车、飞机、火箭的重要材料。在冶金工业做还原剂。
镁与其他金属构成合金,强度较大、机械性能良好,是制造汽车、飞机、火箭的重要材料。在冶金工业做还原剂。
(二)化学性质
1、 能与O2、Cl2、N2等非金属单质反应,产物分别为MgO、MgCl2、Mg3N2。
能与O2、Cl2、N2等非金属单质反应,产物分别为MgO、MgCl2、Mg3N2。
2、与CO2反应:化学方程式为:2Mg+CO2 2MgO+C。
3、与酸反应:镁与非金属如稀硫酸、盐酸等反应生成氢气,离子方程式为:Mg+2H+=Mg2++H2↑。镁与氧化性如浓H2SO4、稀HNO3、浓HNO3在常温下也能反应,但不生成H2。
4、与盐溶液反应:与Zn的盐溶液反应,其离子方程式为:Mg+Zn2+=Mg2++Zn。
(一)物理性质
银白色,有金属光泽,熔点低,硬度小,密度小。
(四)电解MgCl2:MgCl2 Mg+Cl2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com