
1. 性质强弱的规律
|
|



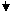

 在“氧化剂+还原剂 → 还原产物+氧化产物”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
在“氧化剂+还原剂 → 还原产物+氧化产物”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
例3.根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是( )。
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
解析:反应(1)中还原剂是I-,还原产物是Fe2+,故还原性I->Fe2+;反应(2)中还原剂是Fe2+,还原产物是Br-,故还原性Fe2+>Br-。综合起来可知还原性I->Fe2+>Br-。
答案:B
4. 电子转移的表示方法
(1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:

MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
|

MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
说明:注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
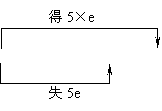 3Cl2+6KOH
3Cl2+6KOH KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
 ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
|
|
|

 KClO3+6HCl
KClO3+6HCl 3Cl2+ 6KCl↑
+3H2O
Cl
Cl
Cl
3Cl2+ 6KCl↑
+3H2O
Cl
Cl
Cl

|
|
|

 若理解为右图则错了。
Cl
Cl
Cl
若理解为右图则错了。
Cl
Cl
Cl

3.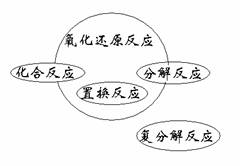 氧化还原反应
氧化还原反应
氧化还原反应与四种基本类型反应之间的关系
化合反应:有单质参加的是氧化还原反应。
分解反应:有单质生成的是氧化还原反应。
置换反应:全部是氧化还原反应。
复分解反应:都是非氧化还原反应。
(如图)
氧化还原反应的基本类型:
(1)自身氧化还原反应:同一种物质的分子内,同种元素(不同价态)或不同种元素的原子(离子)之间发生电子转移的氧化还原反应。
说明:自身氧化还原反应中氧化剂和还原剂必须是同一种物质。
(2)歧化反应:同一种物质分子内同一种元素同一价态的原子(或离子)发生电子转移的氧化还原反应。如:
C12+2NaOH=2NaCl+NaCl0+H20
3N02+H20=2HN03+NO
说明:①歧化反应是自身氧化还原反应的特例;②歧化反应的特点:某元素的中间价态在适宜条件下同时向较高和较低价态转化。
(3)归中反应:同种元素由不同价态(高价态和低价态)转变为中间价态的氧化还原反应。如:
6HCl+KCl03=KCl+3C12↑+3H20
2FeCl3+Fe=3FeCl2
2H2S+S02=3S+2H20
(4)部分氧化还原反应:不同物质之间,部分被氧化或部分被还原的氧化还原反应。
Mn02+4HCl(浓)=MnCl2+2H20+C12↑
2.常见的氧化剂和还原剂
(1)重要的氧化剂:
①活泼非金属单质:F2 、 Cl2、 Br2 、I2 、 O2、O3
②高价氧化物:MnO2、PbO2、 Bi2O5、 CO2(高温)
③高价态酸:HNO3、HClO3、HClO4、浓H2SO4
④高价态盐:KNO3(H+)、 KMnO4(酸性、中性、碱性)、 KClO3、FeCl3、K2Cr2O7(酸性、中性、碱性)
⑤过氧化物:H2O2、Na2O2、 CaO2、 BaO2、 K2O2
⑥其它:HClO、NaClO、漂白粉、NO2、KO2
⑦弱氧化剂:能电离出H+的物质、银氨溶液、新制的Cu(OH)2
(2)重要的还原剂:
①金属单质:IA、IIA、金属活动性顺序表靠前的金属
②非金属单质:H2、C、Si
③变价元素中元素低价态氧化物:SO2、CO
④变价元素中元素低价态的酸、阴离子:H2S、 S2-、HS-、HBr、Br-、HI、I-、浓HCl、Cl-、H2SO3 、HSO3-
⑤变价元素中元素低价态时的盐、碱:Na2SO3、Na2S、FeSO4、Na2S2O3、Fe(OH)2
⑥其它:S、Sn2+、NH3
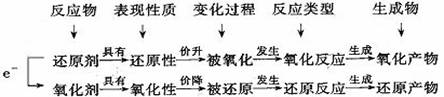
1.氧化剂和还原剂的相关概念
氧化剂:得到电子(所含某元素化合价降低)的反应物;还原剂:失去电子(所含某元素化合价升高)的反应物。
氧化反应:失去电子(或元素化合价升高)的反应;还原反应:得到电子(或元素化合价降低)的反应。
氧化性:物质得到电子的能力或性质;还原性:物质失去电子的能力或性质。
氧化产物:氧化产物是发生氧化反应的物质的生成物;还原产物:还原产物是发生还原反应的物质的生成物。
说明:①氧化剂和还原剂均是指反应物,是一种化学物质,而不是指某一种元素;②氧化剂具有氧化性,氧化剂本身被还原,即发生还原反应,转化为还原产物;还原剂具有还原性,还原剂本身被氧化,即发生氧化反应,转化为氧化产物(图示如下):
例2.在3Cu + 8HNO3(稀)= 3Cu(NO3) 2 + 2NO↑+ 4H2O的反应中,还原剂是__________,氧化剂是__________,还原产物是__________,氧化产物是__________,4molHNO3参加反应,其中被还原的是______mol。
解析:在8摩尔参加反应的硝酸中,所含N元素化合价降低的硝酸只有2摩尔,其余6摩尔的硝酸与铜成盐。所以硝酸在此反应中既表现了氧化性,又表现了酸性。提醒考生在做计算题时更应注意题目要求:对于只有一部分发生氧化(或还原)反应的反应物重点看反应前后化合价发生变化的占多少。
答案:Cu, HNO3,NO,Cu(NO3) 2,1。
3. 氧化还原反应的特征(判断依据)
反应前后某些元素的化合价发生了变化。
例1.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的反应如下:
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO下列叙述中正确的是( )
A.反应①不是氧化还原反应
B.反应②不是氧化还原反应
C.二者都是氧化还原反应
D.在反应①中,Zn发生的是氧化反应
解析:结合题目所给信息,ICl与卤素单质最大的区别是:ICl属于化合物,共用电子对偏向于氯而呈-1价。根据化合价变化判断是否属于氧化还原反应不难看出反应②中所有元素的化合价均没有发生变化,不属于氧化还原反应。同时,需要指出的是,反应①中锌元素的化合价反应后升高了,发生了氧化反应,而碘元素的化合价从+1价降低到-1价,发生了还原反应。
答案:BD
2.氧化还原反应的实质
元素化合价的变化是电子转移的外观表现,电子转移是氧化还原反应的实质。
1.氧化还原反应的定义
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应;反应物所含元素化合价降低的反应称为还原反应。氧化反应和还原反应对立统一于一个氧化还原反应之中。
5.乙醇的分子组成为C2H6O,现采用实验方法确定一个乙醇分子里有几个氢原子能被钠置换.测试装置如下图所示.
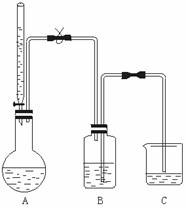
实验操作要点是:全部实验装置必须保证气密性良好;装置A要干燥,酸式滴定管中加入无水乙醇;过量金属钠先在二甲苯(二甲苯不跟金属钠反应)中分散成米粒大小的颗粒;连接B和C的玻璃导管内先要充满水而又不能发生虹吸;从滴定管中缓缓滴入无水乙醇V mL,同时松开弹簧夹,氢气将水由B压入C;待烧瓶恢复到常温后,测出C中所增加水的体积为V1 mL.(气体体积已折算成标准状况)
回答下列问题:
(1)如果实验开始前连接B和C的玻璃管内未充满水,则实验结果将__________.
(2)如果用普通酒精代替无水乙醇做实验,则所得实验结果将____________.
(3)连接A和B的导管的左段垂直部分要相当长,其作用是________________.
(4)把金属钠粉末分散成小颗粒的目的是__________________
(5)若无水乙醇的密度为 g/mL,则乙醇分子中被钠置换的氢原子个数为______.
4. (1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是 。写出与A具有相同官能团的A的所有同分异构体的结构简式 。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是 。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com