
12. 下列离子方程式正确的是
下列离子方程式正确的是
 A. 向盐酸中滴加氨水:H+ +
OH-
= H2O
A. 向盐酸中滴加氨水:H+ +
OH-
= H2O
 B.
Fe(OH)3溶于氢碘酸:Fe(OH)3
+ 3H+ = Fe3+ + 3H2O
B.
Fe(OH)3溶于氢碘酸:Fe(OH)3
+ 3H+ = Fe3+ + 3H2O
 C. 铜溶于稀硝酸:3Cu + 8H+
+ 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
C. 铜溶于稀硝酸:3Cu + 8H+
+ 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
 D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
 [答案]C
[答案]C
 [解析]A项中的氨水应写成分子式,B项发生的是氧化还原反应;C项正确;氯气具有强氧化性将S2O32-氧化成SO42-,正确的离子方程式应为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故D错。
[解析]A项中的氨水应写成分子式,B项发生的是氧化还原反应;C项正确;氯气具有强氧化性将S2O32-氧化成SO42-,正确的离子方程式应为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故D错。
 [考点分析]考查离子方程式的正误判断。
[考点分析]考查离子方程式的正误判断。
11. 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
 A.同周期元素中X的金属性最强
A.同周期元素中X的金属性最强
 B.原子半径X>Y,离子半径X+>Z2-
B.原子半径X>Y,离子半径X+>Z2-
 C.同族元素中Z的氢化物稳定性最高
C.同族元素中Z的氢化物稳定性最高
 D.同周期元素中Y的最高价含氧酸的酸性最强
D.同周期元素中Y的最高价含氧酸的酸性最强
 [答案]B
[答案]B
 [解析]根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O、Y为Cl,B项中的离子半径应为:Z2->X+。
[解析]根据X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,综合判断知X为Na、Z为O、Y为Cl,B项中的离子半径应为:Z2->X+。
 [考点分析]考查元素的推断和元素周期律。
[考点分析]考查元素的推断和元素周期律。

10. 出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
 A. 锡青铜的熔点比纯铜高
A. 锡青铜的熔点比纯铜高
 B.在自然环境中,锡青铜中的锡对铜起保护作用
B.在自然环境中,锡青铜中的锡对铜起保护作用
 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
 [答案]BC
[答案]BC
 [解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
[解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。

 [考点分析]考查合金的性质及影响金属的腐蚀速率的因素。
[考点分析]考查合金的性质及影响金属的腐蚀速率的因素。
9. 下列浓度关系正确的是
下列浓度关系正确的是
 A. 氯水中:c(Cl2)=2[c(
A. 氯水中:c(Cl2)=2[c( )+c(
)+c( )+C(HClO)]
)+C(HClO)]
 B. 氯水中:c(
B. 氯水中:c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)
 C. 等体积等浓度的氢氧化钠与醋酸混合:c(
C. 等体积等浓度的氢氧化钠与醋酸混合:c( )=c(
)=c( )
)
 D.
D.  溶液中:c
溶液中:c
 [答案]D
[答案]D
 [解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O
[解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(
HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c( )>c(
)>c( ),再根据溶液中电荷守恒可以判断c(
),再根据溶液中电荷守恒可以判断c( )>c(
)>c( ;D项比较简单
;D项比较简单
 [考点分析]考查 溶液中离子浓度大小比较 ,要抓住三个守恒。
[考点分析]考查 溶液中离子浓度大小比较 ,要抓住三个守恒。

8. 广州将于2010年承办第16界亚运会。下列措施有利于节能减排、改善环境质量的有
广州将于2010年承办第16界亚运会。下列措施有利于节能减排、改善环境质量的有
 ① 在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
① 在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
 ② 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
② 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
 ③ 加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
③ 加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
 ④ 发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
④ 发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
 ⑤ 使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
⑤ 使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
 A. ①②③④ B. ①②⑤ C. ①②④⑤ D.
③④⑤
A. ①②③④ B. ①②⑤ C. ①②④⑤ D.
③④⑤
 [答案]A
[答案]A
 [解析]垃圾的处理不能进行填埋处理,而应进行分类处理,故⑤错。
[解析]垃圾的处理不能进行填埋处理,而应进行分类处理,故⑤错。
 [考点分析]主要考察如何保护环境及采取哪些措施 。
[考点分析]主要考察如何保护环境及采取哪些措施 。
7.
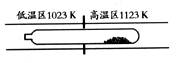 难挥发性二硫化钽(TaS2
)可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
难挥发性二硫化钽(TaS2
)可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2
(g)
TaS2 (s)+2I2
(g) TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
 下列说法正确的是
下列说法正确的是
 A.在不同温度区域,TaI4
的量保持不变
A.在不同温度区域,TaI4
的量保持不变
 B. 在提纯过程中,I2
的量不断减少
B. 在提纯过程中,I2
的量不断减少
 C.在提纯过程中,I2
的作用是将TaS2 从高温区转移到低温区
C.在提纯过程中,I2
的作用是将TaS2 从高温区转移到低温区
 D. 该反应的平衡常数与TaI4
和S2 的浓度乘积成反比
D. 该反应的平衡常数与TaI4
和S2 的浓度乘积成反比
 [答案]C
[答案]C

 [解析]根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误。根据平衡常数表达式可知K与Tal4 和S2 的浓度乘积成正比,D错误。
[解析]根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误。根据平衡常数表达式可知K与Tal4 和S2 的浓度乘积成正比,D错误。
 [考点分析]考查物质的提纯、平衡常数概念。
[考点分析]考查物质的提纯、平衡常数概念。

6. 设nA
代表阿伏加德罗常数(NA )的数值,下列说法正确的是
设nA
代表阿伏加德罗常数(NA )的数值,下列说法正确的是
 A. 1 mol 硫酸钾中阴离子所带电荷数为nA
A. 1 mol 硫酸钾中阴离子所带电荷数为nA
 B. 乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA
个氢原子
B. 乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3nA
个氢原子
 C. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
C. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
 D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA
 [答案]C
[答案]C
 [解析]1molK2SO4 中含有阴离子物质的量为1mol,则所带电荷数为2nA,A错;乙烯和环丙烷混合气可表示为(CH2)n,因此氢原子数为:nA
[解析]1molK2SO4 中含有阴离子物质的量为1mol,则所带电荷数为2nA,A错;乙烯和环丙烷混合气可表示为(CH2)n,因此氢原子数为:nA  =4
nA,B错;Cl2+2NaOH=NaCl+NaClO+H2O,Cl2发生的歧化反应,标况下,22.4L氯气约1mol,此反应转移的电子数为nA,C正确;D项要考虑铁离子的水解,故D错。
=4
nA,B错;Cl2+2NaOH=NaCl+NaClO+H2O,Cl2发生的歧化反应,标况下,22.4L氯气约1mol,此反应转移的电子数为nA,C正确;D项要考虑铁离子的水解,故D错。
 [考点分析]考查阿伏加德罗常数的应用。
[考点分析]考查阿伏加德罗常数的应用。

5、 下列说法都正确的是
下列说法都正确的是
 ① 江河入海口三角洲的形成通常与胶体的性质有关
① 江河入海口三角洲的形成通常与胶体的性质有关
 ② 四川灾区重建使用了大量钢材,钢材是合金
② 四川灾区重建使用了大量钢材,钢材是合金
 ③ “钡餐”中使用的硫酸钡是弱点解质
③ “钡餐”中使用的硫酸钡是弱点解质
 ④ 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
④ 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
 ⑤ 常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键
⑤ 常用的自来水消毒剂有氯气和二氧化氮,两者都含有极性键
 ⑥ 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
⑥ 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物
 A. ①②③④ B. ①②④⑥ C. ①②⑤⑥ D. ③④⑤⑥
A. ①②③④ B. ①②④⑥ C. ①②⑤⑥ D. ③④⑤⑥
 [答案]B
[答案]B
 [解析]根据胶体的性质①正确;钢材是铁和碳的合金,②正确;“钡餐”是硫酸钡,但硫酸钡是强电解质,因为尽管硫酸钡是难溶物但溶于水的部分确实完全电离的 ③错;硅元素位于周期表第三周期第ⅣA主族,是处于金属与非金属的交界处,④正确;氯气是由非极性键组成的单质,⑤错;橡胶是高分子化合物,⑥正确。
[解析]根据胶体的性质①正确;钢材是铁和碳的合金,②正确;“钡餐”是硫酸钡,但硫酸钡是强电解质,因为尽管硫酸钡是难溶物但溶于水的部分确实完全电离的 ③错;硅元素位于周期表第三周期第ⅣA主族,是处于金属与非金属的交界处,④正确;氯气是由非极性键组成的单质,⑤错;橡胶是高分子化合物,⑥正确。
 [考点分析]考查生活材料的组成、特性等。
[考点分析]考查生活材料的组成、特性等。
4.
 下列叙述不正确的是
下列叙述不正确的是
 A.天然气和沼气的主要成分是甲烷
A.天然气和沼气的主要成分是甲烷
 B. 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
B. 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
 C. 纤维素乙酸酯、油脂和蛋白质在一定条件都能水解
C. 纤维素乙酸酯、油脂和蛋白质在一定条件都能水解
 D. 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
D. 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
 [答案]B
[答案]B
 [解析]天然气、煤道坑气和沼气的主要成分都是甲烷,故A正确;因为是等物质的量的乙醇和乙酸再根据乙醇和乙酸分子式可知B错;纤维素乙酸酯、油脂和蛋白质都能在一定条件下水解,C正确;葡萄糖属于单糖,分子式为C6H12O6,蔗糖属于糖类中的二糖,分子式为C12H22O11,按照同系物的定义可知,故D正确。
[解析]天然气、煤道坑气和沼气的主要成分都是甲烷,故A正确;因为是等物质的量的乙醇和乙酸再根据乙醇和乙酸分子式可知B错;纤维素乙酸酯、油脂和蛋白质都能在一定条件下水解,C正确;葡萄糖属于单糖,分子式为C6H12O6,蔗糖属于糖类中的二糖,分子式为C12H22O11,按照同系物的定义可知,故D正确。
 [考点分析]考查生活中常见有机物的性质和同系物的概念。
[考点分析]考查生活中常见有机物的性质和同系物的概念。
3. 下列有关实验操作的说法正确的是
下列有关实验操作的说法正确的是
 A. 可用25ml碱式滴定管量取20.00ml
KmnO4 溶液
A. 可用25ml碱式滴定管量取20.00ml
KmnO4 溶液
 B. 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
B. 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
 C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
 D. 将金属钠在研体中研成粉末,使钠与水反应的实验更安全
D. 将金属钠在研体中研成粉末,使钠与水反应的实验更安全
 [答案]C
[答案]C
 [解析]A项中的KMnO4溶液有很强的氧化性,会腐蚀橡皮管,故不能用碱式滴定管来装,应该用酸式滴定管来量取因此A错;B项若先用蒸馏水润湿会造成溶液浓度的降低。测出值不准确,故B错;D金属钠性质比较活泼易于空气中氧气,水反应,故D错。
[解析]A项中的KMnO4溶液有很强的氧化性,会腐蚀橡皮管,故不能用碱式滴定管来装,应该用酸式滴定管来量取因此A错;B项若先用蒸馏水润湿会造成溶液浓度的降低。测出值不准确,故B错;D金属钠性质比较活泼易于空气中氧气,水反应,故D错。
 [考点分析]考查常见的实验基本操作。
[考点分析]考查常见的实验基本操作。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com