
10. 右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
答案B
[解析]生成灰能与水放出大量的热。
[考点分析]考查常见物质的放热和吸热反应。
20. (20分)
(20分)
 20-1-20-3题为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。20-4题为非选择题,请在答题纸相应位置做答。
20-1-20-3题为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。20-4题为非选择题,请在答题纸相应位置做答。
 20-1.下列有关肥皂的叙述中错误的是:
20-1.下列有关肥皂的叙述中错误的是:
 A.肥皂与纯碱的去污原理相同
A.肥皂与纯碱的去污原理相同

 B.肥皂可以加速油污在水中的分散
B.肥皂可以加速油污在水中的分散
 C.肥皂是油脂在碱性条件下水解生成的
C.肥皂是油脂在碱性条件下水解生成的
 D.肥皂主要成分的分子中含有亲油基团和亲水基团
D.肥皂主要成分的分子中含有亲油基团和亲水基团
答案A
[解析]A中纯碱的去污原理是碱性条件使油污水解,去污原理与肥皂不同;其他均为正确的叙述。

20-2.下列使用化肥、农药的描述中正确的是:
 A.高温多雨时比较适合施用钾肥
A.高温多雨时比较适合施用钾肥
 B.长期施用硫铵会造成土壤板结
B.长期施用硫铵会造成土壤板结
 C.石硫合剂必须与硫酸混合后才能施用
C.石硫合剂必须与硫酸混合后才能施用
 D.过磷酸钙必须经硫酸处理后才能施用
D.过磷酸钙必须经硫酸处理后才能施用
答案B
[解析]A中钾肥易溶于水,多雨时易造成化肥的流失;B中硫铵溶于水呈酸性,易破坏土壤的胶体结构使土壤板结;C中石硫合剂主要成分是多硫化钙,具有渗透和侵蚀病菌细胞及害虫体壁的能力,能在植物体表面形成一层药膜起保护作用,如果和硫酸混合后施用,会生成硫酸钙使石硫合剂失去作用。D中有效成份为Ca(H2PO4)2,属水溶性速效磷肥,应直接使用。
 20-3.下列有关硬水及其软化的说法中错误的是:
20-3.下列有关硬水及其软化的说法中错误的是:
 A.离子交换法可以软化硬水
A.离子交换法可以软化硬水
 B.硬水中含有较多Ca2+、Mg2+
B.硬水中含有较多Ca2+、Mg2+
 C.生产、生活使用的天然水必须经软化
C.生产、生活使用的天然水必须经软化
 D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
答案C
[解析]A、B、D是一些常识,C中生活使用的硬水不是“必须”经软化使用。
 20-4(11分)
20-4(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)
答案
(1)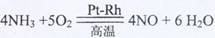
(2)提高氨的转化率和一氧化氮的转化率
(3)增大单位质量的催化剂与反应物的接触面积
(4)3NO2 + H2O = 2HNO3 + NO 加压 降温
[解析](1)
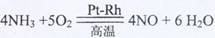
(2)根据平衡原理,增大反应物的浓度,平衡向正反应方向移动,以提高原料的转化率;
(3)这是为了增大铂铑合金的表面积,使接触面积增大,提升催化的效果;
(4)为了提高吸收率,可根据溶解过程放热采用降温处理,且气体的吸收可用加压的方式。





 2009年普通高等学校招生全国统一考试
2009年普通高等学校招生全国统一考试
19. (20分)
(20分)
 19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
 19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
 A.Li,F B.Na,F C.Na,C1 D.Mg,O
A.Li,F B.Na,F C.Na,C1 D.Mg,O
答案B
[解析]比较两原子电负性的差,其中Na与F的电负性差最大。

 19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
答案B
[解析]A选项中,NaCl溶于水是离子晶体的特性,I2是非极性分子溶解度小;B选项中分子的稳定性与键能有关,所以正确;C中形成化合物不一定是最高价或最低价,所以不与最外层电子数呈因果关系;D选项因P4O10发生了反应,所以不能证明P4O10是共价化合物。
 19-3.下列说法中错误的是:
19-3.下列说法中错误的是:
 A.SO2、SO3都是极性分子
A.SO2、SO3都是极性分子
 B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
 C.元素电负性越大的原子,吸引电子的能力越强
C.元素电负性越大的原子,吸引电子的能力越强
 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
答案A
[解析]A选项中,SO3是平面三角形的分子,为非极性分子,明显错误。


 19-4(11分)
19-4(11分)
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
 请回答:
请回答:
 (1)A元素的名称是
;
(1)A元素的名称是
;
 (2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
 (3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
(3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
 (4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
答案

[解析]从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族,所以D也在第4周期;图中离子化合物D:B=1:2,则D为Ca,且B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H。
(2)考查氢键;(3)锰在周期表中的位置,+2价时已经失去个电子,所以排布式为[Ar]3d5;
(4)ρ=  = (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
= (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
V = 

18. (20分)
(20分)
 18-1-18-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。18-4题为非选择题,请在答题纸相应位置做答。
18-1-18-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。18-4题为非选择题,请在答题纸相应位置做答。
 18-1.下列化合物的核磁共振氢谱中出现三组峰的是:
18-1.下列化合物的核磁共振氢谱中出现三组峰的是:
 A.2,2,3,3一四甲基丁烷 B.2,3,4一三甲基戊烷
A.2,2,3,3一四甲基丁烷 B.2,3,4一三甲基戊烷

 C.3,4一二甲基己烷
D.2,5一二甲基己烷
C.3,4一二甲基己烷
D.2,5一二甲基己烷
答案D
[解析]分析题中各项分子中有几种不同的氢,则就有几组峰。A中只有1种氢,B中有4种,C中有4 种,D中有3种。
 18-2.已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为:
18-2.已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为:
 A.5个 B.6个 C.7个 D.8个
A.5个 B.6个 C.7个 D.8个
答案B
[解析]设分子中含羧基的数目是解题的关键。
|
含羧基数 |
氧所占相对原子质量和 |
相对分子质量约为 |
氨基占相对原子质量和 |
碳原子约所占相对原子质量和 |
最多可含碳数 |
是否合理 |
|
1 |
32 |
64 |
16 |
14 |
1 |
不合理 |
|
2 |
64 |
128 |
16 |
48 |
4 |
合理 |
|
3 |
96 |
192 |
16 |
80 |
6 |
合理 |
 18-3.分子式为C5H10O2的酯共有(不考虑立体异构) :
18-3.分子式为C5H10O2的酯共有(不考虑立体异构) :
 A.7种 B.8种 C.9种 D.10种
A.7种 B.8种 C.9种 D.10种
答案C
[解析]为了不出现遗漏,写的时候可以按如下分类来写异构体:
甲酸丁酯4种(丁基4种异构)、乙酸丙酯2种(丙基2种异构)、丙酸乙酯1种、丁酸甲酯2种(丁酸的烃基为丙基,丙基2种异构)共9种。
 18-4(11分).以下是某课题组设计的合成聚酯类高分子材料
18-4(11分).以下是某课题组设计的合成聚酯类高分子材料 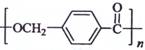 的路线:
的路线:

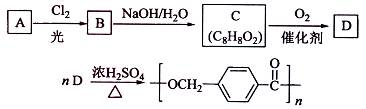
 已知:
已知:
 ①A的相对分子质量小于110,其中碳的质量分数约为0.9;
①A的相对分子质量小于110,其中碳的质量分数约为0.9;
 ②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:

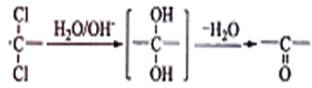
 ③C可发生银镜反应。
③C可发生银镜反应。
 请根据以上信息回答下列问题:
请根据以上信息回答下列问题:
 (1)A的分子式为
;
(1)A的分子式为
;
 (2)由A生成B的化学方程式为
,反应类型是
;
(2)由A生成B的化学方程式为
,反应类型是
;
 (3)由B生成C的化学方程式为
,该反应过程中生成的不稳定中间体的结构简式应是
;
(3)由B生成C的化学方程式为
,该反应过程中生成的不稳定中间体的结构简式应是
;
 (4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
(4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
答案
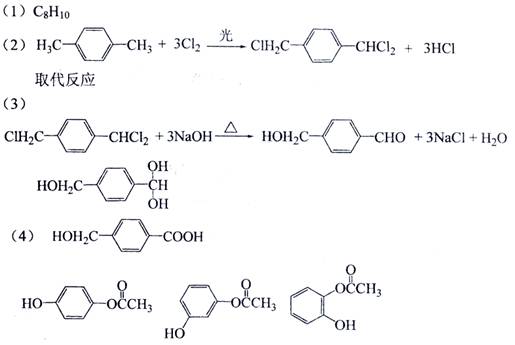
[解析]合成题通常用逆推法:

逆推的第三步用到了题中所给的信息。(4)中能水解,且水解产物之一为乙酸,则一定为乙酸酯,所以有邻、间、对三种同分异构体。

17. (9分)
(9分)
 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
 (1)A的分子式为
:
(1)A的分子式为
:
 (2)A与溴的四氯化碳溶液反应的化学方程式为
,反应类型是 ;
(2)A与溴的四氯化碳溶液反应的化学方程式为
,反应类型是 ;
 (3)已知:
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
;
 (4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式
;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式
;
 (5)在一定条件下,由A聚合得到的高分子化合物的结构简式为
。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为
。
答案(1)C8H8;
(2)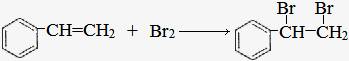 ;加成反应
;加成反应
(3)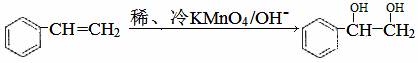
(4)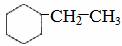 ; (5)
; (5)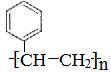
[解析](1)m(C)=92.3%×104=96 则m(H)=8,此含量不可能含其他原子。则96÷12=8 所以分子式为C8H8;
(2)该分子中含苯环,且分子能与溴的四氯化碳溶液反应,所以A应为乙烯基苯,该反应为加成反应;
(3)分子中有碳碳双键,直接套用信息可得结果;
(4)加氢反应,若只加成碳碳双键,则含H 9.43%,若苯环也加氢,则含H 14.3%,后者符合题意。
(5)按碳碳双键的加聚反应写即可。


 选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。

16. (9分)
(9分)
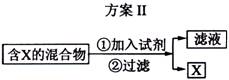
 下图表示从固体混合物中分离X的2种方案,请回答有关问题。
下图表示从固体混合物中分离X的2种方案,请回答有关问题。

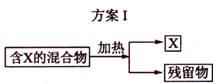
 (1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
(1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
 (2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
 (3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
答案(1)加热时可升华,或易挥发 热稳定性好,且没有挥发性
(2)浓硝酸,Ag+2HNO3(浓) = AgNO3 + NO2 ↑+ H2O;
Cu + 4 HNO3(浓) = Cu(NO3)2 + 2NO2 ↑+2 H2O
(3)

[解析](1)从题中给的信息可理解为升华或蒸馏,因此X的性质为加热时可升华,或易挥发。残留物必须热稳定性好,且没有挥发性。
(2)金、银、铜三种金属金的活泼性最差,不能与硝酸反应,选用硝酸作为试剂,过滤即可。
(3)三种氧化物中,SiO2、Al2O3都能与强碱发生反应,但Fe2O3不会反应,可以选浓NaOH溶液反应后过滤。但如果SiO2的含量大,则不宜用前面所述方法,可选用盐酸溶解,过滤后去除SiO2,再在混合液中加入过量的溶液,过滤得Fe(OH)3沉淀,洗涤后加热分解的方法。
15. (9分)
(9分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;

 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案(1)负极材料为Li(还原剂),Li – e- = Li+
(2)2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)出现白雾,有刺激性气体生成SOCl2 + H2O = SO2 ↑+ 2HCl↑
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
[解析]分析反应的化合价变化,可得Li为还原剂 ,SOCl2为氧化剂。
(1)负极材料为Li(还原剂),Li – e- = Li+
(2)负极反应式可由总反应减去负极反应式得到:2SOCl2 + 4 e- = 4Cl- + S + SO2
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气体生成。
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应
14. (8分)
(8分)



 汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
 (1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由
能转化为
能,最终转化为机械能;
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为 ,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由
能转化为
能,最终转化为机械能;
 (2)通过车用燃油的精炼加工处理,可减少汽车尾气中的
(填化学式,多填本空不得分)排放;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的
(填化学式,多填本空不得分)排放;
 (3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式
。
答案(1)4CmHn +(4m+n)O2  2nH2O
+ 4mCO2 ;化学;热能
2nH2O
+ 4mCO2 ;化学;热能
(2)SO2 (3)2NOx+ 2xCO  N2 + 2x CO2
N2 + 2x CO2
[解析](1)汽油燃烧的化学方程式为:
4CmHn
+(4m+n)O2  2nH2O
+ 4mCO2 ,燃烧过程为化学能转化为热能。
2nH2O
+ 4mCO2 ,燃烧过程为化学能转化为热能。
(2)精炼汽油可以减少其中硫的含量从而减少二氧化硫的排放大。
(3)这和(1)一样,也是属于对未知物反应方程式的配平:2NOx+ 2xCO  N2 + 2x CO2
N2 + 2x CO2
13. (9分)
(9分)
 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。



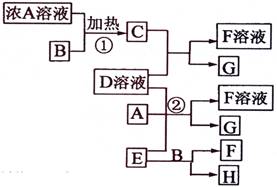

 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
答案(1)反应①的方程式:4HCl(浓) + MnO2  MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(2)反应②的离子方程式:6I-+ ClO3- + 6H+ = 3I2+Cl- + 3H2O
(3)2H2O2 2H2O + O2↑(也可用高锰酸钾加热分解)
2H2O + O2↑(也可用高锰酸钾加热分解)
(4)D溶液与Pb(NO3)2
反应生成沉淀为PbI2 ,PbI2 Pb2+ +
2I-
Pb2+ +
2I-
Ksp= c(Pb2+)·c(I-)2 = c(Pb(NO3)2 ) ÷2 ·(10-2÷2)2= 7.0×10-9
所以c(Pb(NO3)2 ) = 5.6×10-4 mol·L-1
[解析]首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
12.已知:Fe2O3(s)
+  C(s)
=
C(s)
=  CO2(g)
+ 2 Fe(s) ΔΗ=234.1 kJ·mol-1
CO2(g)
+ 2 Fe(s) ΔΗ=234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔΗ=-393.5 kJ·mol-1
则2 Fe(s)+  O2(g)
= Fe2O3(s) 的ΔΗ 是
O2(g)
= Fe2O3(s) 的ΔΗ 是
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
答案A
[解析] (2)=(1)就可得2 Fe(s)+
(2)=(1)就可得2 Fe(s)+  O2(g) = Fe2O3(s),则ΔΗ=
O2(g) = Fe2O3(s),则ΔΗ= ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。
ΔΗ2-ΔΗ1=-824.4 kJ·mol-1。

 第Ⅱ卷
第Ⅱ卷
 本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com