
13. 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应

 kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
 体体积的关系如下表所示:
体体积的关系如下表所示:
 气体体积 气体体积 C(Y)/mol·L-1 C(Y)/mol·L-1  温度℃ 温度℃ |
1 |
2 |
3 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.09 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
 A.m>n
A.m>n
 B.Q<0
B.Q<0
 C.温度不变,压强增大,Y的质量分数减少
C.温度不变,压强增大,Y的质量分数减少
 D.体积不变,温度升高,平衡向逆反应方向移动
D.体积不变,温度升高,平衡向逆反应方向移动

 答案C
答案C
 [解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
[解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
 [考点分析]化学平衡移动原理
[考点分析]化学平衡移动原理

12. 关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
 H+4):③>①
H+4):③>①
 B.水电离出的c(H+):②>①
B.水电离出的c(H+):②>①
 C.①和②等体积混合后的溶液:c(H+)=c(OH
C.①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3·H2O)
)+c(NH3·H2O)
 D.①和③等体积混合后的溶液:c(NH+4)>c(Cl
D.①和③等体积混合后的溶液:c(NH+4)>c(Cl )>c(OH
)>c(OH )>c(H+)
)>c(H+)
 答案B
答案B
 [解析]A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,B项不正确。盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,C项正确。D项比较简单。
[解析]A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,B项不正确。盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,C项正确。D项比较简单。
 [考点分析]弱电解质的电离、盐类的水解、离子浓度大小比较
[考点分析]弱电解质的电离、盐类的水解、离子浓度大小比较
11. 向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的
 沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p
g。则下列关系不正确的是
沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p
g。则下列关系不正确的是
 A.
A. B.
B. C.n=m+17Vc D.
C.n=m+17Vc D.
 <
<  <
<
 答案C
答案C
 [解析]根据化学方程式可得,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,所以A项正确;B项中p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,所以B项正确,而得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,C项中忽略了体积的单位。
[解析]根据化学方程式可得,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,所以A项正确;B项中p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,所以B项正确,而得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,C项中忽略了体积的单位。
 [考点分析]化学计算
[考点分析]化学计算
10. X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物 。下列说法正确的是
。下列说法正确的是
A.  还原性:X的氧化物>Y的氧化物>Z的氢化物
还原性:X的氧化物>Y的氧化物>Z的氢化物
B.  简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.  YX
YX 、M
、M Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D.  Z元素的最高价氧化物的水化物的化学式为HZO4
Z元素的最高价氧化物的水化物的化学式为HZO4
 答案D
答案D
 [解析]X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素。其最高价氧化物的水化物为HClO4。三种元素中S元素的非金属性最弱,因此其氢化物的还原性最强。根据M2Y又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素,SO2为极性分子,而K2S属于离子化合物。
[解析]X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素。其最高价氧化物的水化物为HClO4。三种元素中S元素的非金属性最弱,因此其氢化物的还原性最强。根据M2Y又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素,SO2为极性分子,而K2S属于离子化合物。
 [考点分析]元素周期律和元素周期表的综合应用
[考点分析]元素周期律和元素周期表的综合应用
9. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518
kJ/mol。下列热化学方程式书写正确的是
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518
kJ/mol。下列热化学方程式书写正确的是
 A.2H+(aq) +
A.2H+(aq) + (aq)+
(aq)+ (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H O(1);
O(1); H=
H= 57.3 kJ/mol
57.3 kJ/mol
 B.KOH(aq)+
B.KOH(aq)+ H
H SO4(aq)=
SO4(aq)=
 K
K SO4(aq)+H
SO4(aq)+H O(I);
O(I);
 H=
H= 57.3kJ/mol
57.3kJ/mol
 C.C8H18(I)+
C.C8H18(I)+  O
O (g)=8CO
(g)=8CO (g)+ 9H
(g)+ 9H O;
O;
 H=
H= 5518
kJ/mol
5518
kJ/mol
 D.2C8H18(g)+25O
D.2C8H18(g)+25O (g)=16CO
(g)=16CO (g)+18H
(g)+18H O(1);
O(1);
 H=
H= 5518
kJ/mol
5518
kJ/mol
 答案B
答案B
 [解析]A项不符合中和热的定义;C项中生成物水为气态,D项中辛烷的物质的量不是1mol,所以ACD错误。
[解析]A项不符合中和热的定义;C项中生成物水为气态,D项中辛烷的物质的量不是1mol,所以ACD错误。
 [考点分析]燃烧热、中和热概念的理解及热化学方程式书写正误判断
[考点分析]燃烧热、中和热概念的理解及热化学方程式书写正误判断
8. 在下列给定条件的溶液中,一定能大量共存的离子组是
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液: 、、H+、
、、H+、 、
、
B.能使pH试纸呈红色的溶液:Na+、NH+4、 、
、
C.FeCl2溶液:K+、、Na+、、 、、
、、
D. =0.1 mol/L的溶液:Na+、K+、
=0.1 mol/L的溶液:Na+、K+、 、
、
答案D
 [解析]A项中H+与HSO3-不能大量共存;B项隐含条件是酸性溶液NO3-在酸性条件下具有强氧化性,可氧化I-,C项中Fe2+和AlO2-可发生双水解而不能大量共存。 D项为碱性条件,可大量存在。
[解析]A项中H+与HSO3-不能大量共存;B项隐含条件是酸性溶液NO3-在酸性条件下具有强氧化性,可氧化I-,C项中Fe2+和AlO2-可发生双水解而不能大量共存。 D项为碱性条件,可大量存在。
 [考点分析]离子共存
[考点分析]离子共存
7.下列有关物质检验的实验结论正确的是
|
选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有 |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有 |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
答案B
[解析]A项可能受到Ag+影响生成AgCl沉淀;C能够使品红溶液褪色的气体不一定就是 还可能是其他气体比如氯气;D、能发生银镜反应的官能团为醛基,而醛基还可能存在与甲酸或甲酸某酯、甲酸盐中。
还可能是其他气体比如氯气;D、能发生银镜反应的官能团为醛基,而醛基还可能存在与甲酸或甲酸某酯、甲酸盐中。
[考点分析]常见离子检验、物质鉴别综合运用
6.开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是
A. 氮化硅陶瓷是新型无机非金属材料
B. C60属于原子晶体,用于制造纳米材料
C. 纤维素乙酸酯属于天然高分子材料
D. 单晶硅常用于制造光导纤维
答案A
[解析]B、C60为分子晶体;B、纤维素为天然高分子化合物,而纤维素硝酸酯是人工合成的、D、二氧化硅是制造光导纤维的主要材料。
[考点分析]本题主要考查化学与生活、化学基本概念.
28. 答案
答案 (1)FeS2
(1)FeS2

 (2)
(2)

 (3)a b d
(3)a b d

 (4)SO3(g) + H2O(l)
= H2SO4(l);ΔH=-130.3kJ/mol
(4)SO3(g) + H2O(l)
= H2SO4(l);ΔH=-130.3kJ/mol

 (5)①SO2
+ Br2 + 2H2O = 4H+ + 2Br- + SO42-
(5)①SO2
+ Br2 + 2H2O = 4H+ + 2Br- + SO42-

 ②14.56 2.31g
②14.56 2.31g


 [解析]本题主要考查硫酸工业、热化学方程式的书写、计算等。
[解析]本题主要考查硫酸工业、热化学方程式的书写、计算等。
 (1)根据原子守恒即可判断该物质为FeS2。
(1)根据原子守恒即可判断该物质为FeS2。
 (2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2
(2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2
 2SO3。
2SO3。
 (3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
(3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
 (4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
(4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
 (5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
(5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
 设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
 132X + 115y=10…………………………………………………….(1)
132X + 115y=10…………………………………………………….(1)
 10g时说明铵盐不足由N守恒知
10g时说明铵盐不足由N守恒知
 n(NH3)=2X + y
n(NH3)=2X + y
 20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
 HSO4-
+ OH-
= SO42- + H2O
HSO4-
+ OH-
= SO42- + H2O
 1 1
1 1
 2y 2y
2y 2y
 NH4+ + OH- = NH3 +
H2O
NH4+ + OH- = NH3 +
H2O
 1
1
1
1
 50C×10-3-2y 50C×10-3-2y
50C×10-3-2y 50C×10-3-2y
 由于产生的氨气一样多
由于产生的氨气一样多
 n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)
n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)
 30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O
 1 1
1 1
 3y 3y
3y 3y
 NH4+ + OH- =
NH3
+ H2O
NH4+ + OH- =
NH3
+ H2O
 1
1
1
1
 50C×10-3-3y
0.04
50C×10-3-3y
0.04
 所以
所以
 50C×10-3-3y=0.04…………………………………………………….(3)
50C×10-3-3y=0.04…………………………………………………….(3)
 联立(1) (2) (3)解得
联立(1) (2) (3)解得
 X=0.02mol
y=0.064mol
C=4.64mol/L
X=0.02mol
y=0.064mol
C=4.64mol/L
 氮的质量百分含量=
氮的质量百分含量= 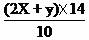 ×100%=(0.04+0.064)
×14/10×100%=14.56%
×100%=(0.04+0.064)
×14/10×100%=14.56%
 15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
 HSO4- + OH- = SO42-
+ H2O
HSO4- + OH- = SO42-
+ H2O
 1
1
1
1
 1.5y 1.5y
1.5y 1.5y
 NH4+ + OH- =
NH3
+ H2O
NH4+ + OH- =
NH3
+ H2O
 1
1
1
1
 50C×10-3-1.5y 50C×10-3-1.5y
50C×10-3-1.5y 50C×10-3-1.5y
 n(NH3)=
50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol
n(NH3)=
50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol
 m(NH3)=0.136×17=2.31g
m(NH3)=0.136×17=2.31g


28. (15分)
(15分)
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:


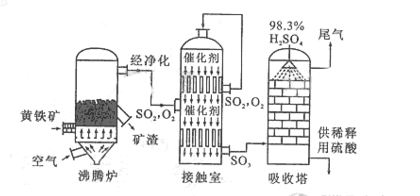

 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整
 4 +11
4 +11
 (2)接触室中发生反应的化学方程式是 。
(2)接触室中发生反应的化学方程式是 。
 (3)依据工艺流程图判断下列说法正确的是(选填序号字母)
。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
。
 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
 b. 过量空气能提高
b. 过量空气能提高 的转化率
的转化率
 c. 使用催化剂能提高
c. 使用催化剂能提高 的反应速率和转化率
的反应速率和转化率
 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁
 (4)每160g
(4)每160g 气体与
气体与 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
 (5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的 和铵盐。
和铵盐。
 ①
① 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 。
。 吸收
吸收 的离子方程式是 。
的离子方程式是 。
 ②
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的
②
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
 部分测定结果;
部分测定结果;
 铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
 计算:该铵盐中氮元素的质量分数是
%; 若铵盐质量为15.00g。
浓硫酸增加的质量为 。
(计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是
%; 若铵盐质量为15.00g。
浓硫酸增加的质量为 。
(计算结果保留两位小数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com