
43. (09年海南化学·20.4)(11分)
(09年海南化学·20.4)(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为
:
(1)氨催化氧化的化学方程式为
:
 (2)原料气中空气必须过量,其主要原因是
;
(2)原料气中空气必须过量,其主要原因是
;
 (3)将铂铑合金做成薄丝网的主要原因是
;
(3)将铂铑合金做成薄丝网的主要原因是
;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为
,为了提高水对二氧化氮的吸收率,可采取的措施为
(答2项)。
答案:(11分)
(1)4NH3+5O2 4NO+6H2O
4NO+6H2O (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
(4)3NO2+H2O=2HNO3+NO 加压 降温(4分)
解析:(1)
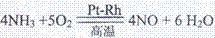
(2)根据平衡原理,增大反应物的浓度,平衡向正反应方向移动,以提高原料的转化率;
(3)这是为了增大铂铑合金的表面积,使接触面积增大,提升催化的效果;
(4)为了提高吸收率,可根据溶解过程放热采用降温处理,且气体的吸收可用加压的方式。
42. (09年海南化学·16)(9分)
(09年海南化学·16)(9分)
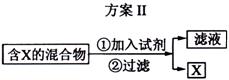
 下图表示从固体混合物中分离X的2种方案,请回答有关问题。
下图表示从固体混合物中分离X的2种方案,请回答有关问题。

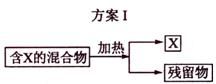
 (1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
(1)选用方案I时,X应该具有的性质是
,残留物应该具有的性质是
;
 (2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是 ,有关反应的化学方程式为
;
 (3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)
。
答案:(9分)
 (1)有挥发性(或易升华)
受热不挥发,且具有较高的热稳定性(2分)
(1)有挥发性(或易升华)
受热不挥发,且具有较高的热稳定性(2分)
 (2)HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)HNO3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
[或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Ag+2HNO3(浓)=AgNO3+NO2↑+2H2O]

 (3分)
(3分)
 (3)
(3)

 (4分)(其他合理答案:也可给分)
(4分)(其他合理答案:也可给分)
解析:(1)从题中给的信息可理解为升华或蒸馏,因此X的性质为加热时可升华,或易挥发。残留物必须热稳定性好,且没有挥发性。
(2)金、银、铜三种金属金的活泼性最差,不能与硝酸反应,选用硝酸作为试剂,过滤即可。
(3)三种氧化物中,SiO2、Al2O3都能与强碱发生反应,但Fe2O3不会反应,可以选浓NaOH溶液反应后过滤。但如果SiO2的含量大,则不宜用前面所述方法,可选用盐酸溶解,过滤后去除SiO2,再在混合液中加入过量的溶液,过滤得Fe(OH)3沉淀,洗涤后加热分解的方法。
41. (09年海南化学·13)(9分)
(09年海南化学·13)(9分)
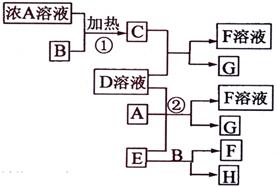
 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。


 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
答案:(9分)


 (1)MnO2+4HCl(浓)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
 (2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
(2)6I-+ClO3-+6H+=3I2+Cl-+3H2O(2分)
 (3)2H2O2
(3)2H2O2 2H2O+O2↑或2KMnO4
2H2O+O2↑或2KMnO4 K2MnO4+MnO2+O2↑(其他合理答案:也给分)(2分)
K2MnO4+MnO2+O2↑(其他合理答案:也给分)(2分)
 (4)5.6×10-4mol·L-1(3分)
(4)5.6×10-4mol·L-1(3分)
解析:首先得破框图,G为紫黑色固体单质,一般可预测为碘单质,可推得C物质为氯气,则A为盐酸、B为二氧化锰;E在二氧化锰的催化下制取H,则E为氯酸钾、H为氧气;F为氯化钾;于是D一定为碘化钾。所以推出A盐酸、B二氧化锰、C氯气、D碘化钾、E氯酸钾、F氯化钾、G碘、H氧气。
40.(16分)(08年山东理综·30)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的+Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2
 (填“>”、“=”或“<”)2 L,原因是
。装置改进后可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为
。
(填“>”、“=”或“<”)2 L,原因是
。装置改进后可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为
。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4=ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:

答案:
(1)①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答Na0H不影响得分)
②75%乙醇
(2)天平、烧杯、500 mL容量瓶、胶头滴管
(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定
(4)c d
解析:(1)①要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+和Fe3+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-。Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+。②除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中。
(3)2NaCl+2H2O 2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
2NaOH+Cl2↑+H2↑,在阴级区内产生的Cl2能与该区生成的NaOH反应NaCl、NaClO和H2O,使得部分的Cl2被消耗,所以同样条件下收集到的Cl2小于2L。
39.(8分)(08年海南化学·13)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4︰5,化合物D是重要的工业原料。

(1)写出A在加热条件下与H2反应的化学方程式___________________________。
(2)写出E与A的氢化物反应生成A的化学方程式___________________________。
(3)写出一个由D生成B的化学方程式____________________________________。
(4)将5 mL0.10 mol·L-1的E溶液与10 mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ____7(填“大于”、“小于”或“等于”),理由是 ;
③加热反应后的溶液,其pH_____(填“增大”、“不变”或“减小”),理由是_______________。
答案:(8分)(1)H2+S H2S(写成可逆反应也正确)
H2S(写成可逆反应也正确)
(2)H2SO3 + 2H2S=3S + 3H2O
(3)C+2H2SO4(浓) CO2
↑+2SO2 ↑+2H2O(其他合理答案也给分如Cu+ 2H2SO4(浓)
CO2
↑+2SO2 ↑+2H2O(其他合理答案也给分如Cu+ 2H2SO4(浓) CuSO4
+SO2↑+ 2H2O等)
CuSO4
+SO2↑+ 2H2O等)
(4)①H2SO3 +2OH- = SO32- + 2H2O
②大于 Na2SO3溶液中SO32-发生水解使溶液显碱性
③增大 升高温度促进Na2SO3溶液的水解
解析:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64∶80=4∶5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S。E为H2SO3。
38.(11分)(08年广东化学·23)
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(2)下列有头硅材料的说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
答案:
(1)①SiHCl3+H2
 Si+3HCl
Si+3HCl
②3SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸
(2)BC
(3)生成白色絮状沉淀,又刺激性气味的气体生成;解释:SiO32-与NH4+发生双水解反应,SiO32- + 2 NH4+ + 2H2O ===2NH3·H2O + H2SiO3↓
解析:(1) ①写出由纯SiHCl3制备高纯硅的化学反应方程式:
SiHCl3+H2
 Si+3HCl
Si+3HCl
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式3SiHCl3+3H2O====H2SiO3+H2↑+3HCl;H2还原SiHCl3过程中若混入O2,可能引起的后果是:高温下,H2遇O2发生爆炸。
(2)ABCD
解释:SiC和Si3N4均为原子晶体,熔点高,性质稳定,AB正确。光导纤维的材料为SiO2,C正确。普通玻璃的主要成分为Na2SiO3和CaSiO3,它是以石英砂(SiO2)、石灰石(CaCO3)和纯碱(Na2CO3)为主要原料反应制成的。Na2CO3+SiO2 Na2SiO3+CO2;CaCO3+SiO2
Na2SiO3+CO2;CaCO3+SiO2 aSiO3+CO2,D正确。常温下,Si只能与唯一一种酸HF反应不与HCl反应,E错。
aSiO3+CO2,D正确。常温下,Si只能与唯一一种酸HF反应不与HCl反应,E错。
(3)写出实验现象并给予解释:生成白色絮状沉淀,又刺激性气味的气体生成;SiO32-与NH4+发生双水解反应,SiO32- + 2 NH4+ + 2H2O ==== 2NH3·H2O + H2SiO3↓。
37.(07年山东理综·30)(16分)下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。

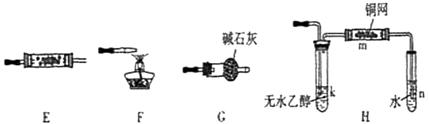
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。需要加热的仪器装置有 (填代号),m中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改改加浓氨水,圆地烧瓶内改加 NaOH 固体,E内装有铂铹合金网,按A→G→E→D装置程序制取干燥氧气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: 。
②实验中观察到E内有红棕色气体现出,证明氨气具有 性。
答案:(1)ACBECF AB之间的C装置中溶液保持澄清,EF之同的C装置中溶液变浑浊
(2)关闭 打开 k
m 2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)①氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。②还原
解析:(1)根据实验要求,A装置中通入的气体为CO和CO2的混合气,在A中,CO2 被氢氧化钠吸收,若要获得纯净干燥的CO,需要选取装置C,证明CO2 被除尽,然后通过盛有浓硫酸的B除去水蒸气,要验证CO的还原性,需要装有CuO的装置E,验证CO的氧化产物CO2 ,还需要装置C,最后需要F除去为反应的CO。所选装置的连接顺序是ACBECF,能验证CO的氧化产物的实验现象是:AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。
(2)停止通入CO和CO2
的混合气体,需要关闭活塞a,然后打开活塞b,此时稀硫酸与碳酸钠溶液(CO2
与NaOH反应生成的)反应,反应生成的CO2气体进入E中,并与 与Na2O2反应产生氧气,氧气通过D除去可能存在的CO2,通过B除去水蒸气,得到纯净干燥的氧气,氧气氧化乙醇的条件是需要加热且有铜做催化剂,因此需要加热k使乙醇挥发,并且加热m,使氧气与乙醇蒸气反应,反应的化学方程式是:2CH3CH2OH+O2 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(3)氢氧化钠固体易吸水并且在溶于水时放出大量的热,氢氧化钠溶于水后溶液中的OH-的浓度增大,这些因素均能浓氨水中的化学平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-向逆反应方向移动,使浓氨水中的氨气放出。根据常识可以判断出在E中出现的红棕色气体应该是NO2
,由氨气和NO2中氮元素的化合价可以判断氨气被氧化生成NO2
氨气体现出的是还原性。
NH4++OH-向逆反应方向移动,使浓氨水中的氨气放出。根据常识可以判断出在E中出现的红棕色气体应该是NO2
,由氨气和NO2中氮元素的化合价可以判断氨气被氧化生成NO2
氨气体现出的是还原性。
9.8×109g x y
则 ,解得x=8.0×103t y=9.83×109kJ。
,解得x=8.0×103t y=9.83×109kJ。
36.(07年宁夏理综·31A)化学选考题(15分)
A.[化学-选修化学与技术]
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1) 已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
答案:(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应。(2)增大压强对提高SO2转化率无显著影响,反而会增加成本。(3)否 否 (4)浓硫酸 (5)8.0×103t 9.83×109kJ
解析:(1)根据表格中的数据可以看出,在相同压强下(如在0.1MPa下)升高温度(如由400℃升高到500℃)时SO2的转化率降低(由99.2%降低为93.5%),即升高温度时此化学平衡向逆反应方向移动,而升高温度化学平衡应该向吸热反应方向移动,所以此反应的正反应为放热反应。
(2)根据表格中的数据可以得知:在0.1MPa(即常压1atm下)SO2的转化率已经很高,如在400℃时已达99.2%,若增大压强到10MPa(即100atm),压强增大了100倍但是SO2的转化率值增大为99.9%,只增大了0.7%变化不大。而压强增大100倍,需要对设备的材料、动力、能源等都作相应的提高,既要增大成本投入。
(3)使用催化剂只能改变化学反应的速率,改变反应到达平衡的时间,不能使化学平衡发生移动,即对SO2的转化率不产生影响;而在一定条件下,化学反应放出的热量与参加反应的反应物的量成正比,因SO2的转化率不变,所以反应放出的热量也不会增大。
(4)在生产实际中是采用98.3%的浓硫酸作吸收剂来吸收SO3的。因为若用水进行吸收会形成酸雾,将影响SO3的吸收速率和效率。
(5)1万吨98%的硫酸含H2SO4的质量:9.8×109g。 设需要SO3的质量为x,该反应产生的热量为y。
H2SO4 - SO3 - 放出的热量
98g 80g 196.9kJ
32.(09年海南化学·3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
答案:A
解析:除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成份。溶液中可用这样的方法: Na2CO3 + H2O + CO2 = 2NaHCO3。
33 .(09年海南化学·7)用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
.(09年海南化学·7)用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
 A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
答案:C
解析:设此铅氧化物的化学式PbxOy ,
PbxOy-- y[O]-- yCO-- y CO2-- yCaCO3
16y 100y
m(O)=1.28g 8.0g
所以m(Pb) = 13.7g- 1.28g = 12.42g
x∶y =  ∶
∶ =3∶4
=3∶4
34 .(09年海南化学·9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
.(09年海南化学·9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
 A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
 C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
答案:B
解析:题中的关键词“过量NaOH溶液”,A中只能生成4种盐;B生成5种(NaCl、NaClO、NaAlO2、NaNO3、Na2SO4);C中CaO不能生成盐;D中CO不能成盐。
35 .(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:
.(09年海南化学·11)在5mL 0.05 mo1/L的某金属氯化物溶液中,滴加0.1 mo1/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为:

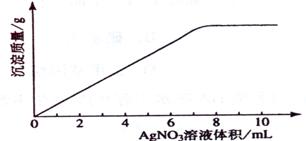
 A.+1 B.+2 C.+3 D.+4
A.+1 B.+2 C.+3 D.+4
答案:C
解析:设氯化物化学式为MClx
MClx -- x AgNO3
1 x
5mL×0.05 mol·L-1 0.1 mol·L-1×7.5mL
x = 3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com