
9.在相同状况下,将下列四种混合气体:①体积比为3:1的NH3和N2,②体积比为1:1的 NO和NO2,③体积比为1:1的NO和O2,④体积比为4:1的NO2和O2,分别置于完全相同的试管里,并倒置于水槽中。充分反应后,液面上升的高度分别为h1、h2、h3、h4,下列关系正确的是( )
A.h1>h2>h3>h4 B.h4> h3> h1> h2
C.h4> h1>h3> h2 D.h2 >h3> h1 >h4
8.在标准状况下,相同质量的下列气体中体积最大的是( )
A.O2 B.Cl2 C.N2 D.CO2
7.在铁和铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,则m1和m2的关系是( )
A.m1一定大于m2 B.m1可能等于m2
 C.m1一定等于m2
D.m1可能大于m2
C.m1一定等于m2
D.m1可能大于m2
6.下列各组离子,可以大量共存的是 ( )
A.H+、K+、Fe2+、NO3- B.OH-、Cl-、Na+、NH4+
C.Mg2+、K+、Cl-、NO3- D.Ag+、Na+、NO3-、Br-
5.通常情况下,氮气不易发生化学反应的原因是( )
A.N2是非极性分子 B.N2的相对分子质量较小
C.N2分子由N≡N键结合而成,键能大 D.氮的非金属性比氧弱
4.下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.常温下都可与木炭快速反应 B.常温下都能与铜较快反
C.露置于空气中,溶液质量均减轻 D.露置于空气中,溶液浓度均降低
3.下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧
A.①②⑤ B.①③⑤ C.②③④ D.①②③
2.下列氧化还原反应中,同一元素既被氧化又被还原的是( )
A.2NO+O2=2NO2 B.N2+O2=2NO
C.N2+3H2=2NH3 D.3NO2+H2O=2HNO3+NO
1.下列盛放物质的方法错误的是( )
A.将金属锂保存在石蜡中
B.少量的白磷可保存在水中
C.碱溶液用带磨口玻璃瓶塞的试剂瓶保存
D.硝酸银溶液盛放在棕色试剂瓶中
44.



 (09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(09年江苏化学·18)(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
 (1)在ClO2的制备方法中,有下列两种制备方法:
(1)在ClO2的制备方法中,有下列两种制备方法:
 方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
 方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
。
 (2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
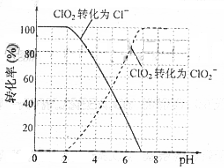
 饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-

 完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
 ① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式
。
 ②请完成相应的实验步骤:
②请完成相应的实验步骤:
 步骤1:准确量取VmL水样加入到锥形瓶中。
步骤1:准确量取VmL水样加入到锥形瓶中。
 步骤2:调节水样的pH为7.0~8.0
步骤2:调节水样的pH为7.0~8.0
 步骤3:加入足量的KI晶体。
步骤3:加入足量的KI晶体。
 步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
 步骤5: 。
步骤5: 。
 步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
 ③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
③根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
 ④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
④若饮用水中ClO2-的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
 答案:
答案:
(1)方法二制备的ClO2中不含Cl2
 (2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
(2)①ClO2-+4H++4I-=Cl-+2I2+2H2O
 ②调节溶液的pH≤2.0
②调节溶液的pH≤2.0
 ③
③
 ④Fe(OH)3
④Fe(OH)3

 解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I-
解析:(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)pH≤2.0时,ClO2-也能被I- 完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0
完全还原成Cl-,那么I-要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出pH≤2.0时,ClO2-与I-反应的离子方程式与pH为7.0~8.0的溶液中存在ClO-可以判断调节溶液的pH≤2.0 。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案
。求引用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系。Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案

 [考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
[考点分析]关注题目给与的信息从题目中挖掘有用的信息,注意关键词如本题的连续碘量法。
45 .(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
.(09年天津理综·9)(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

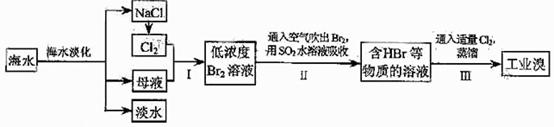
 (1)请列举海水淡化的两种方法: 、 。
(1)请列举海水淡化的两种方法: 、 。
 (2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
 (3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为
。
 (4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
。
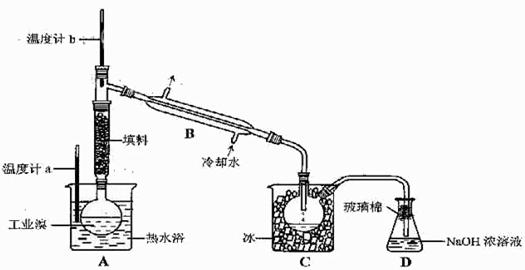
 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论:
 ①图中仪器B的名称:
。
①图中仪器B的名称:
。
 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
。
 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
 ④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色 分液(或蒸馏)
解析:本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl
+ 2H2O  2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
2NaOH+H2↑+Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com