
0.20
________
ν正=ν逆
Ⅲ
0.12
0.10
ν正=ν逆
Ⅱ
0.60
0.06
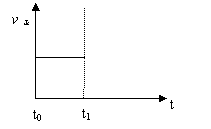 (3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)相同温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号
c(H2O)/mol?L-1
c(CO)/mol?L-1
c(H2)/mol?L-1
ν正、ν逆比较
I
C (s) + H2O(g)  CO (g) +H2 (g)
△H= +131.3 kJ•mol-1
CO (g) +H2 (g)
△H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)移走一部分,平衡_______________(向左移 / 向右移 / 不移动)。
22.水煤气是重要的燃料和化工原料,可用水蒸气通过炽热的炭层制得:
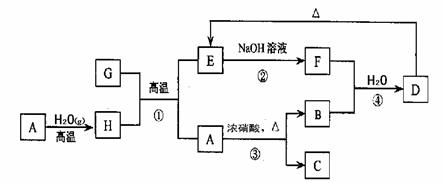 21.(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。
21.(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。
(1) 若A、G为同一主族元素的非金属单质,化合物B是一种能引起温室效应的气体。则反应③的化学方程式为 ,反应④的离子方程式为 。
(2) 若A、G为生活中常见的金属单质,B是红棕色气体,D是一种白色胶状沉淀,则反应①的化学方程式为 , 反应②的离子方程式为 。
20.(6分)A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同主族,C与E同主族。A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2―离子含10个电子。
(1)D的单质在C的单质中燃烧,生成化合物甲。写出化合物甲的电子式 。
(2)由A、B两种元素组成最简式为BA3的化合物乙与C的单质在足量KOH溶液中形成燃料电池的负极反应式为 。
(3)由A、C、D、E四种元素按原子个数比1:3:1:1组成物质丙溶于水后溶液显酸性,则溶液中各种离子的浓度由大到小的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com