
18.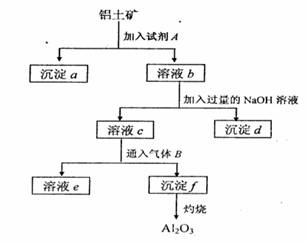 (13分)铝土矿的主要成分是A12O3,含有Fe2O3、
(13分)铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。
回答下列问题:
(1)沉淀物的化学式分别是:
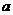 ;d
;
;d
;
f ;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式 、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式 、 。
(4)气体B能否改用试剂A代替?为什么? , 。
17.(10分)实验室用烧碱配制500 mL 0.32mol·L-1的NaOH溶液。
①需称量 g的烧碱固体,固体应放在 中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号) 。
A.烧杯 B.量筒 C.玻璃棒 D.l000mL容量瓶 E.漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是 (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是 : 偏高的是 :
A.称量时药品和砝码位置颠倒 B.称量时间过长
C.溶液未冷却即转入容量瓶 D.容量瓶洗净后未烘干
E.定容时俯视刻度线
F.定容后倒转摇匀,发现液面低于刻度线而未加水补充
16、含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
第Ⅱ卷 (非选择题,共52分)
15.在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:( )
A.8∶3 B.6∶1 C.3∶1 D.1∶3
14.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是: ( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+
13.在反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中,1mol还原剂失去电子的物质的量为: ( )
A.6mol B.8mol C.10mol D.12mol
12.用NA表示阿伏加德罗常数的值。下列叙述正确的是: ( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
11.同温、同压下,等质量的SO2和CO2相比较,下列叙述中正确的是:( )
A.密度之比为11∶16 B.体积之比为11∶16
C.分子数之比为1∶1 D.摩尔质量之比为11∶16
10.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤ C.①②④ D.②③④⑤
9.珠江三角洲曾遭遇“咸潮”,水源中含氯量高达7100mg/L,远远超过正常值250 mg/L。以下说法正确的是( )
A.“咸潮”中氯离子浓度可达0.2mol·L-1
B.自来水厂可加入适量AgNO3溶液除去Cl-
C.自来水厂可用蒸馏法来净化水
D.直接用“咸潮”水作为水源,对人体无害
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com