
30.(8分)C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
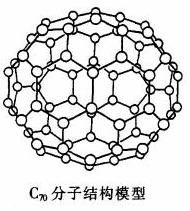 (1)C70分子中每个碳原子只跟相邻的3个
(1)C70分子中每个碳原子只跟相邻的3个
碳原子形成化学键;
(2)C70分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系
遵循欧拉定理:顶点数+面数-棱边数=2。
根据以上所述确定:
(1)C70分子中所含的单键数为 ,
双键数为 ;
(2)C70分子中的五边形有 个,六边形有 个。
化学答题卡(实验班)
29. (5分)
(1)下列有关晶体的叙述中错误的是( )
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl- 或Na+
C.在CsCl晶体中每个Cs+ 周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
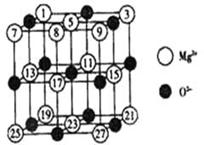 (2)已知MgO的晶体结构属于NaCl型。某同学
(2)已知MgO的晶体结构属于NaCl型。某同学
画出的MgO晶胞结构示意图如下图所示,请改正图
中错误: 。
(用文字表述)
(3)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
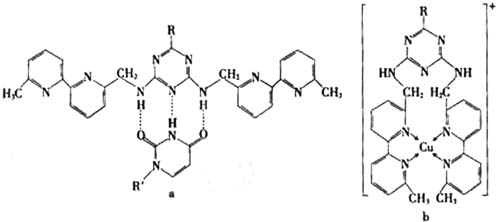
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:
a中含 ,b中含 。(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
28.(11分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。请回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。请回答下列问题:
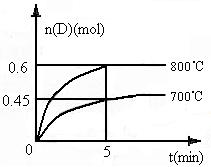 (1)700℃时,0-5min内,以B表示的平均反应速
(1)700℃时,0-5min内,以B表示的平均反应速
率为____________________________。
(2)能判断该反应是否达到化学平衡状态的依据是
(多选扣分)__________________。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)= c (C)
(3)若最初加入1.0molA和2.2molB,利用图中数据
计算800℃时的平衡常数K=_______________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol·L-1,c(B)=0.50mol·L-1,c(C)=0.20mol·L-1,c(D)=0.018mol·L-1,则此时该反应将______________(填“向右移动”、“向左移动”或“处于平衡状态”)。
27.(12分)有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为ns n np n+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
(1)上述元素中,E元素的原子结构示意图为 ;
D元素的外围电子排布式为 ;
(2)下列分子结构图中的 和
和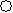 表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示上述元素的原子中除去最外层电子的剩余部分, 小黑点表示没有形成共价键的最外层电子,短线表示共价键。

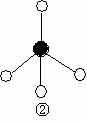

则在以上分子中,中心原子采用sp3杂化形成化学键的非极性分子是 (用化学式表示); 在③的分子中有 个σ键和 个π键。
(3)AgNO3 溶液与足量C的氢化物水溶液反应生成的配合物,其化学式为 ,该配合物中心原子通过 杂化方式与配位体以
键相结合。
26.(10分)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
⑴ 用元素名称表示: C
⑵ 用电子式表示离子化合物A2B的形成过程: 。
⑶ D元素形成的单质的结构式为: ;A、B、E形成的化合物的电子式为: 。
⑷ D、E形成的化合物分子的空间构型为: ,该物质为 (填“极性分子”或“非极性分子”)
(5) A、B、C、D四种元素的第一电离能由大到小的顺序为 (用元素符号表示)。
25. (6分)在下列物质中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、
⑥金刚石、⑦SiO2晶体、⑧MgCl2、⑨干冰。
⑴只含有离子键的离子化合物是
;
⑵含离子键、极性键和配位键的化合物是
;
⑶含有非极性键的离子晶体是
;
⑷含有极性键和非极性键的非极性分子是
;
⑸熔化时需要破坏共价键的化合物是 。
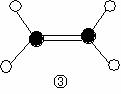
24. 控制适合的条件,将反应
控制适合的条件,将反应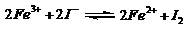 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
 B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
 C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
 D. 电流计读数为零后,在甲中溶入FeCl2固体,
D. 电流计读数为零后,在甲中溶入FeCl2固体,
乙中石墨电极为负极

第II卷(共52分)
23. 经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的
排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情况是 
A.该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.该溶液可以由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.在上述溶液中加入适量NaOH,离子浓度大小可改变为:
|

22. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价
B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的酸性
D、气态氢化物的稳定性:HmY小于H nX
21. 在一密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器
bB(g)达到平衡后,保持温度不变,将容器
体积增加1倍,达到新的平衡后,B的浓度是原来的40 % ,则

A.平衡向正反应方向移动 B.物质A的转化率变大
C.物质B的质量分数增加 D.a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com