
40.(09兰州)(6分)某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应。实验数据记录如下:
|
所加盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
盐酸的质量/g |
25 |
25 |
25 |
25 |
|
烧杯及所盛物质总质量/g |
181.2 |
204.4 |
228.6 |
253.6 |
请你据此分析计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是 g。
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
(09乐山)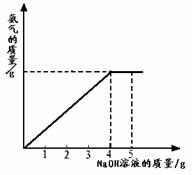 38.(8分)硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0
g 该硝酸铵样品于容器中,滴入5.0g
20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示:
38.(8分)硝酸铵是农业生产中常用的化学肥料。为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0
g 该硝酸铵样品于容器中,滴入5.0g
20%的NaOH溶液。发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O。反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如右图所示:
完成有关计算:
(1)NH4NO3中各元素的质量比为(H:N:O) ;
(2)样品中硝酸铵的质量分数;
(3)所得溶液中NaNO3的质量分数(保留两位小数)。
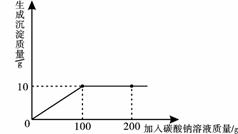 (09娄底)32.小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3
=CaCO3↓+2NaCl。求:
(09娄底)32.小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3
=CaCO3↓+2NaCl。求:
(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是 70 g。
(2)样品中氯化钠的质量是多少?
71
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
72
32题. 70.100(2分)
71-72解:设样品中氯化钙的质量为x,生成氯化钠的质量为y?
CaCl2+Na2CO3 =CaCO3↓+2NaCl
111 ? 100 117 ??
x 10g y
111∶?x? = 100∶10g ?x?=11.1g (1分)
117∶y = 100∶10g ?y?=11.7g (1分)
样品中氯化钠的质量=13.4g-11.1g=2.3g (1分)
所得溶液中溶质质量分数 = ×100%=7% (1分)
(其它合理解法均可记分)
答:略
29.(09嘉兴)在今年实验考查中,某同学抽到了有关物质间反应的试题。在实验中他发现了一个问题:在碳酸钠溶液中滴加硝酸银溶液后产生了白色沉淀,再滴加稀硝酸后观察到的现象与预想的不一样,除了产生气泡外,还有不能溶解的物质。
(1)你觉得此时他应如何填写滴加稀硝酸后的实验现象? ▲ (填“沉淀全部溶解.产生气泡”或“沉淀部分溶解,产生气泡”)
(2)事后,他在老师的帮助下进行了深入的分析,找到了出现这一问题的原因:由于前一组同学实验后用自来水洗涤试管,而自来水是含有氯离子的,所以沉淀中含有 ▲ (填化学式)不能被稀硝酸溶解。
(09乐山) 37.(6分)右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
37.(6分)右图是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
[查阅资料]
(1)酒石酸是一种易溶解于水的固体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO 3受热不分解。
[提出问题]
NaHCO3在发酵粉加水或加热时如何产生CO2?
[猜 想]
甲.……
乙.酒石酸与NaHCO3在溶液中反应产生CO2
丙.NaHCO3加热产生CO2
[实验探究]
 (1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是
。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是
;
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是
。小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是
;
(2)小英同学为探究猜想丙设计了右图所示的实验装置:
小英另取适量NaHCO3粉末加入a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为 。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是 。
[小 结]
NaHCO3在发酵粉中产生CO2的条件是 ;
NaHCO3受热发生变化的化学方程式为 ;
10.(09杭州)化胆中的氮肥很多是铵盐。已知氨气通入水中后,其溶液呈碱性。将硫酸铵和氢氧化钙混合后放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,这是检验铵盐的方法。上述实验现象说明( )
A.铵盐和碱的反应是属于复分解反应类型 B.氨气比空气轻
C.能使红色石蕊试纸变蓝色就是氨气 D. 铵盐能和碱反应放出氨气
(09湖州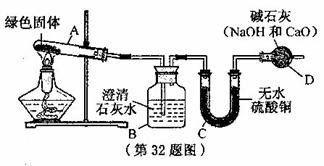 32 .绝大多数古代青铜器和铜器上都有绿色斑点,这些绿色斑点是铜长时间和氧气等物质发生化学反应生成的铜绿[ Cu2 ( OH )2 CO3 ] ,铜绿不稳定,受热后可分解生成三种物质。
32 .绝大多数古代青铜器和铜器上都有绿色斑点,这些绿色斑点是铜长时间和氧气等物质发生化学反应生成的铜绿[ Cu2 ( OH )2 CO3 ] ,铜绿不稳定,受热后可分解生成三种物质。
为探究铜绿受热后生成的物质,小莉同学从某种铜器上取下适量的铜绿,进行实验。 ① 连接装置如图,并检查装置的气密性。
② 将干燥后的铜绿放入试管A 中加热。
( l )试管口为什么要略向下倾斜?
( 2 ) A 装置中绿色固体逐渐变成黑色。取少量黑色固体放人另一试管中,加入稀硫酸,观察到黑色固体逐渐溶解,变成蓝色溶液。则可推测铜绿分解产物中有
( 3 ) B装置中澄清石灰水变浑浊,则可推测铜绿分解产物中 ( 4 ) C 装置中无水硫酸铜变蓝色,小莉同学认为铜绿分解产物中有水,但小明同学认为这还不能作出确切的推断。若要推断铜绿产物中是否有水,应如何改进实验装置?
31.(09杭州) (6分)过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2 Na2CO4 +4HCl== 4NaCl+2CO2↑ +O2 ↑+2H2O.工业用的过碳酸钠往往含有少量的碳酸钠。为了测定工业用的过碳酸钠的纯度,可以选择利用下列仪器(包括仪器中的药品)及石蕊试液进行实验,请回答下列问题:
(1)、取适量过碳酸钠样品与足量的稀盐酸反应,只要测定反应过程中产生的
(写化学式)体积,就可推算出过碳酸钠的纯度。
(2)、请选取该实验需要的装置,并按正确连接顺序排列 (填字母,仪器中的试剂都是足量的)。
(3)、判定过碳酸钠试样是否完全反应的实验操作方法和现象是
(09杭州)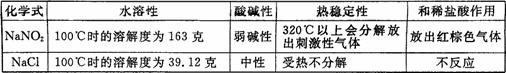 18.生活中常有发生亚硝酸钠中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味;工业用盐中常混有亚硝酸钠,有关氯化钠和亚硝酸钠的部分资料如下表:
18.生活中常有发生亚硝酸钠中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味;工业用盐中常混有亚硝酸钠,有关氯化钠和亚硝酸钠的部分资料如下表:
如要检验食盐中有无亚硝酸钠,下列判定方法错误的是
A.在食盐中加人盐酸,观察有无红棕色气体放出
B.蒸干100克100℃食盐饱和溶液,称量溶质的质量是不是39. 12克
C.用pH试纸测定食盐溶液的酸碱性
D.把食盐加热到3200C以上观察有无刺激性气体放出
37.(09嘉兴)农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素。
 (1)氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 ▲ (填序号)。
(1)氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 ▲ (填序号)。
①KCl; ②NH4HCO3; ③Ca3(PO4)2。
(2)“测土配方”可以实现“缺什么、补什么”,使用该技术的好处是 ▲ 。
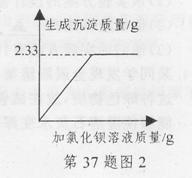 (3)某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)
(3)某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)
21、(每空1分,化学方程式2分,共8分) 炭(C), Na2CO3或Na2O、Na2CO3
反应物中无氢元素(或违背质量守恒定律,答案合理即可), Na2CO3 ,
Na2CO3溶液显碱性也会使酚酞变红, 4Na+3CO2==2Na2CO3+C(2分)
19、(每空1分,化学方程式2分,共6分)(1)MgSO4, BaCl2
(2)MgSO4+2NaOH==Mg(OH)2↓+Na2SO4 (3)MgCl2+2AgNO3==2AgCl↓+Mg(NO3)2
(09宿迁21.(8分)在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中
继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出问题]黑色颗粒和白色物质是什么?
[进行猜想]甲认为黑色颗粒是 ,白色物质可能是Na2O或
或 ,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是
[查阅资料]氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O == 2NaOH
[实验探究]甲同学对白色物质进行实验探究。
|
实验方案 |
实验操作 |
实验现象 |
结论 |
|
方案1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
|
方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 。 |
|
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
[反思评价]丙同学认为方案1得到的结论不正确,其理由是
[得出结论]钠在二氧化碳中燃烧的化学方程式为
36.(09兰州)(6分)下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。请回答:

(1)写出下列物质的化学式:A. C. 。
(2)得到F溶液的操作Ⅰ的名称为: 。
(3)若I是红褐色沉淀,请写出G + F → I的化学方程式:
(4)指出反应①的基本类型是 反应。
(09宿迁19.(6分)X、Y、Z三种物质中均含有镁元素,有如下转化关系:
根据以上转化关系写出:
(1)X、试剂甲的化学式:X , 甲
(2)反应①的化学方程式:
(3)反应②的化学方程式:
35.(09兰州)(6分)实验室有两瓶标签破损的无色溶液甲、乙,推知它们只能是稀盐酸和硫酸钠溶液。某校化学兴趣小组的同学设计用化学方法和物理方法区分它们。请回答有关问题:
(1)化学方法:在不选用酸碱指示剂、pH试纸的情况下,选择不同物质类别的试剂进行区分(物质类别是指单质、氧化物、酸、碱、盐等)。
|
|
所选试剂 |
实
验 现
象 及
结 论 |
|
方法一 |
|
|
|
方法二 |
|
|
(2)物理方法:小明同学仅使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分
开来了。请你猜测一下他的做法(简要叙述操作方法及判断方法) 。
20.(29分)
活动Ⅰ
(1)③;CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (每小格2分,共4分)
(2)2NaOH + CO2 = Na2CO3 + H2O (2分)
(3)排水(或向上排空气);不易溶于水(或密度比空气大);带火星的木条
(梅格2分,共6分)
活动Ⅱ
[作出猜想] ① ② (2分)
二氧化碳与超氧化钾都不含氢元素,根据质量守恒定律,不可能生成含有氢元素的酸与碱(答案合理即可) (2分)
[进行实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
将二氧化碳与超氧化钾反应后的固体取样加入稀盐酸,把产生的气体通入足量的澄清石灰水中 |
有大量气泡产生 澄清石灰水变浑浊 |
猜想 ③ (填序号)是正确的,二氧化碳与超氧化钾反应生成的化合物是
碳酸钾 |
或
|
实验步骤 |
实验现象 |
实验结论 |
|
将二氧化碳与超氧化钾反应后的固体取样加入蒸馏水,配成饱和溶液,再加入饱和氢氧化钙溶液 |
无色溶液中出现白色浑浊 |
猜想 ③ (填序号)是正确的,二氧化碳与超氧化钾反应生成的化合物是
碳酸钾 |
(每小格1分,共7分,其他合理答案均给分。实验步骤、现象、结论要一一对应)
[交流与讨论]
(1)4KO2 + 2CO2 = 2K2CO3 + 3O2 (2分)
(2)取戴鉴定的生氧剂少量于试管中,滴加少量的水,观察是否有气泡产生,将带火星的木条伸入试管内,观察木条是否复燃,即可判断生氧剂是否需要更换 (2分)
(3)超氧化钾能吸收呼出气体中的二氧化碳,转化为能供给呼吸的氧气 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com