
29.(09娄底)小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
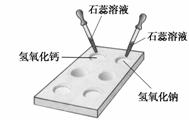 (1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
|
|
氢氧化钠溶液 |
氢氧化钙溶液 |
|
加紫色石蕊溶液 |
56 |
57 |
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方 程式 58 。
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式
 59 。
59 。
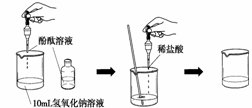
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显 60 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 61 反应。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
① 62
② 63
29题. 56. 溶液变蓝 57. 溶液变蓝 58.CO2+Ca(OH)2 =CaCO3↓+H2O(2分)
13、(09临沂)分别将盛有浓盐酸、浓硫酸、固体氢氧化钠、固体氯化钠的试剂瓶,敞口放置一段时间后,试剂质量减少的是 ,试剂质量增加而且变质的是 (填写试剂名称)。
(09娄底)
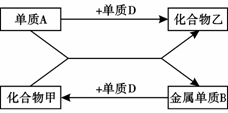 24. 下图为初中化学几种常见物质及其转化关系,请根据图示回答:
24. 下图为初中化学几种常见物质及其转化关系,请根据图示回答:
(1)化合物甲中的元素有 40 种。
(2)金属单质B可能是 41 (填名称),化合物乙可能是 42 (填化学式)。
24题. 40. 2 41. 铜(铁或其他合理答案均记分)42. CO2 (H2O或其他合理答案均记分
25.(4分,每空l分)
(1)H2SO3 (2)S+O2 SO2
SO2
(3)SO3+H2O===H2SO4 (4)BaCl2+H2SO4===BaSO4↓+2HCl
(09乐山)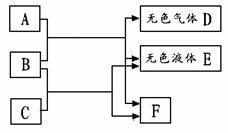 34.(3分)如图所示,A、B、C、D、E、F均是初中化学常见物质。A与B发生的是复分解反应,B与C发生的是中和反应,F是人体正常生理活动必不可少的一种盐。
34.(3分)如图所示,A、B、C、D、E、F均是初中化学常见物质。A与B发生的是复分解反应,B与C发生的是中和反应,F是人体正常生理活动必不可少的一种盐。
结合图中信息,回答有关问题:
(1)E的化学式为 ;
(2)A与B反应的化学方程式为 ;
(3)C与D反应的化学方程式为 ;
25.(4分)模拟酸雨形成的流程如下图所示。硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。
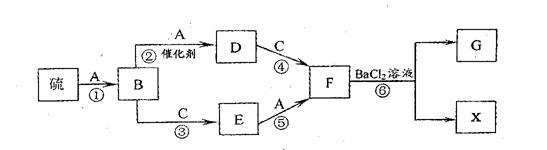
试填空。
(1)E的化学式为: ▲ 。
(2)反应①的化学方程式为: ▲ 。
(3)反应④的化学方程式为: ▲ 。
(4)反应⑥的化学方程式为: ▲ 。
7.(09扬州)现有三种物质:①洁厕灵(含无机酸等)②生理盐水③烧碱溶液,pH大小关系为
A.①>②>③ B.③>②>① C.②<①<③ D.③<①<②
45.(09徐州)(8分)某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。
实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请你对脱脂棉燃烧的原因进行分析_______。
实验2:向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
[提出问题]溶液为什么先变红,过了一会,红色又褪去了呢?
[猜想]甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是_____________________。
[查阅资料]①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
[猜想]通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原凶义进行了猜想。
猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
[实验探究]请你将下列实验方案填写完整。
|
猜想 |
实验操作 |
实验现象 |
结论 |
|
A |
取过氧化钠与水反应后的溶液放入试管中,_____ ___________________________________________ |
_________________ |
猜想A 正确 |
|
B |
取过氧化钠与水反应后的溶液放入试管中, ________________________________________ |
________________ |
猜想B 错误 |
[得出结论]根据实验分析,过氧化钠与水反应除了生成氢氧化钠和氧气外,还存在另一反应,则另一反应的化学方程式为____________________________________。
.(8分)化学方程式2分,其余每空l分。
实验l:反应中产生氧气和放出热量,使脱脂棉达到燃烧的条件
实验2:猜想:氢氧化钠溶液与二氧化碳反应后生成的碳酸钠溶液也显碱性,也能使酚酞试液变为红色
|
实验操作 |
实验现象 |
结论 |
|
加入适量的二氧化锰后,将 带火星的术条放在试管口 |
产生气泡,木条复燃 |
猜想A正确 |
|
先加入适量的水,然后再滴 加酚酞试液 |
溶液变红,一会红色又消失 |
猜想B错误 |
[得出结论]Na2O2+2H2O=2NaOH+H2O2
42.(09徐州)(5分)A、B、C、D、E均为初中化学中不同类别的物质,它们的变化关系如图所示,其中红色物质A在一定条件下可以转化为单质B,“--”表示相连的两种物质能发生反应。则:
(1)D的化学式为_______。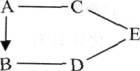
(2)A转化为B的化学方程式_。
(3)C与E反应的化学方程式_______。
化学方程式2分,其余每空l分。
(1)CuSO4等 (2)Fe2O3+3CO高温2Fe+3CO2等 (3)NaOH+HCl=NaCl+H2O等
18、(每空1分,共8分)(1)化学能 电能 (2)浓硫酸 水
(3)CO (答案中含有CO即可) (4)①灼烧(或加热),②NH3;NH4Cl
16.(09黔东南)维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。
[实验目的]测定不同饮料中维生素C的含量。
[实验原理]
(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变
色。
[实验试剂]碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
[实验过程]
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
步骤2:用4支相同的胶头滴管分别向①-④支试管中逐滴滴加碘水至刚好变色,并记录滴数。
[实验记录]
|
测定物质 |
① |
② |
③ |
④ |
|
滴入碘水的数量(滴) |
1 |
8 |
15 |
5 |
试回答下列问题:
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由: 
;
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水
[回顾与反思]实验中所用的淀粉溶液的作用是 。16.[实验原理](2)蓝
[实验记录](1)橙汁(或③)
(2)不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度(其他合理答案也可)
(3)A B D
[回顾与反思]确定维生素C是否与碘水完全反应
(09宿迁18.(8分)化学电池是一类重要的能源,按工作性质可分为:一次电池(例如干电池)和二次电池(可充电电池,例如铅酸蓄电池)。请简要回答下列各空
(1)铅酸蓄电池放电时能量转变是 能转变成 能。
(2)宿迁经济开发区某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将 沿器壁缓慢注入 中,并不断搅拌以防液体飞溅。
(3)使用铅酸蓄电池的电动车与使用汽油燃料的轻便摩托车相比,电动车不会产生
等有害气体,但电池对土壤和水体的污染是不容忽视的。
(4)废旧干电池中许多物质是可以回收利用的。某种型号干电池的剖面如下图所示。
现对干电池内的填充物(MnO2、C、可溶性糊状物和水)进行探究,请填空:
①
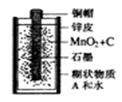 取填充物溶于水,过滤、洗涤、干燥,得到黑色不溶物。再
取填充物溶于水,过滤、洗涤、干燥,得到黑色不溶物。再
经过__________处理,即可得到纯净的MnO2;
② 取①中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热
产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化
肥,则该气体的化学式为______;另一份加入AgNO3溶液,产生
白色沉淀,滴加稀HNO3沉淀不溶解,则可推知糊状物的化学式为________ 。
21.(8分)
(1)(2分)过滤(1 分) 铁架台(带铁圈)、或三角架(1 分)
(2)(3分)铁、铜(或Fe、Cu)(2分) Fe + H2SO4 = FeSO4 + H2↑(1 分)
(3)(1分)CuO + H2SO4 = CuSO4 +H2O
(4)(2分)Ⅱ(1 分) 途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净。合理表述均给分。1 分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com